
| A. | 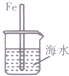 图中,插人海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 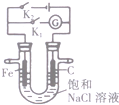 图中,闭合K2,铁电极的腐蚀速率比闭合K1时慢 | |
| C. | 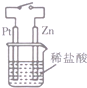 图中,接通开关时,Zn的腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 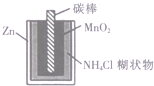 图中,锌锰电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
分析 A.越靠近底端,越不易腐蚀;
B.闭合K1时Fe作负极,闭合K2,Fe作阴极;
C.接通开关时,如Zn连接电源负极,则不易腐蚀;
D.正极上得电子发生还原反应,体现还原性.
解答 解:A.中间既接触空气又接触水的部位腐蚀最严重,越靠近底端,氧气的含量越少,越不易腐蚀,故A错误;
B.闭合K1时Fe作负极,负极失电子被腐蚀,闭合K2,Fe作阴极,阴极被保护,所以闭合K2,铁电极的腐蚀速率比闭合K1时慢,故B正确;
C.接通开关时,Zn为负极,则不会产生气体,Pt上生成氢气,故C错误;
D.该原电池中锌作负极,二氧化锰作正极,正极上得电子发生还原反应,所以Zn-MnO2干电池自放电腐蚀主要是由Zn还原作用引起,故D错误.
故选B.
点评 本题综合考查电化学知识,侧重于金属的腐蚀与防护以及原电池的工作原理的考查,题目难度不大,注意把握电极反应.


科目:高中化学 来源: 题型:解答题
 铁及其化合物在国民经济的发展中起着重要作用.
铁及其化合物在国民经济的发展中起着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mo1 Na2O2所含的阴离子 | |
| B. | 1 L0.1 mol•L-1氨水中的NH${\;}_{4}^{+}$ | |
| C. | 12.5mL 16 mo1•L-1的浓硫酸能溶解的Cu | |
| D. | 4.6g N02气体所含的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
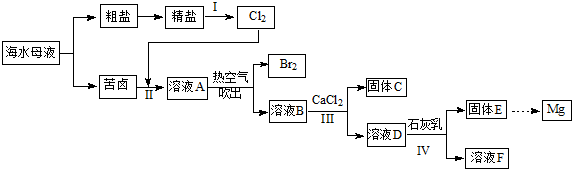
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热可增强纯碱溶液去污能力:CO32-+2H2O?H2CO3+2OH- | |
| B. | 用醋酸溶液除水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO2+2CaSO4 | |
| D. | 碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:CO32-+Ca2+=CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1 mol•L-1盐酸中含有nA个HCl分子 | |
| B. | 32g O2与O3的混合物含有2nA个氧原子 | |
| C. | 1L 1 mol•L-1CuCl2溶液中含有nA个Cu2+ | |
| D. | 1mol Na与足量Cl2反应,转移2nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用氧化铝冶炼金属铝:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | |
| B. | 工业上用过量的NaOH溶液吸收SO2:SO2+OH-=HSO${\;}_{3}^{-}$ | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO${\;}_{2}^{-}$+H2O | |
| D. | 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
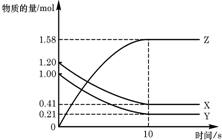 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
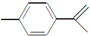 ,下列关于这种物质的说法中不正确的是( )
,下列关于这种物质的说法中不正确的是( )| A. | 该物质难溶于水 | |
| B. | 分子式为C10H14 | |
| C. | 既能发生取代反应,又能发生加成反应 | |
| D. | 既能使酸性高锰酸钾褪色又能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com