

| A. | 反应的化学方程式为:2N?M | B. | t2时,正逆反应速率相等,达到平衡 | ||
| C. | t1时,N的浓度是M的浓度的3倍 | D. | t3时,正反应速率大于逆反应速率 |
分析 根据反应过程中物质的量的变化量知,N是反应物、M是生成物,达到平衡状态时,△n(M)=(5-2)mol=3mol、△n(N)=(8-2)mol=6mol,
A.相同时间内,各物质的物质的量变化量之比等于其计量数之比,从而确定方程式;
B.反应达到平衡状态时正逆反应速率相等;
C.t1时,N的浓度是M的浓度的2倍;
D.反应达到平衡状态正逆反应速率相等.
解答 解:根据反应过程中物质的量的变化量知,N是反应物、M是生成物,达到平衡状态时,△n(M)=(5-2)mol=3mol、△n(N)=(8-2)mol=6mol,
A.相同时间内,各物质的物质的量变化量之比等于其计量数之比,所以N、M的计量数之比=6mol/L:3mol/L=2:1,所以方程式为2N?M,故A正确;
B.t2时,两种物质的物质的量相等,但反应继续向正反应方向移动,所以没有达到平衡状态,正反应速率大于逆反应速率,故B错误;
C.t1时,N的物质的量是6mol、M的物质的量是3mol,容器体积相等,所以N的浓度是M的浓度的2倍,故C错误;
D.t3时,各物质的物质的量不变,说明反应达到平衡状态,所以正逆反应速率相等,故D错误;
故选A.
点评 本题考查图象分析,明确图象中纵横坐标含义及平衡状态特点是解本题关键,易错选项是B,注意:反应速率图象中只有正逆反应速率相等的点才是平衡状态点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜锌原电池中铜是正极 | |
| B. | 在镀件上镀铜时可用金属铜作阳极 | |
| C. | 用电解法精炼铜时粗铜做阳极 | |
| D. | 在电解饱和食盐水的装置可用铜做阳极,且电极产物是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入新制氢氧化铜悬浊液,加热;再加入溴水 | |
| B. | 先加入溴水;再加入酸性高锰酸钾溶液 | |
| C. | 先加入酸性高锰酸钾溶液;再加入银氨溶液,微热 | |
| D. | 先加入银氨溶液;再加入新制氢氧化铜悬浊液,加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.04mol/(L•s) | ||
| C. | v(C)=0.03mol/(L•s) | D. | v(D)=0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种蛋白质为人工合成的高分子化合物 | |
| B. | 这种蛋白质遇到HgCl2的浓溶液将发生盐析 | |
| C. | 这种蛋白质能完全水解生成单糖分子 | |
| D. | 这种蛋白质分子中存在“-CONH-”的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
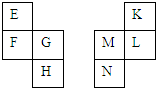 E~N等元素在周期表中的相对位置如下表.E与K的原子序数相差4,K的一种单质是空气中含量最多的物质,H与N属同周期元素,下列判断不正确的是( )
E~N等元素在周期表中的相对位置如下表.E与K的原子序数相差4,K的一种单质是空气中含量最多的物质,H与N属同周期元素,下列判断不正确的是( )| A. | 原子半径:M>L>K | |
| B. | F的单质与氧气反应只生成一种氧化物 | |
| C. | H与N的原子核外电子数相差14 | |
| D. | 最高价氧化物的水化物酸性:K>L>M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 进行分液时,分液漏斗中的下层液体,从下端流出,上层液体则从上口倒出 | |
| C. | 萃取、分液前需对分液漏斗进行检漏 | |
| D. | 将上面的塞子拿下,可以保证分液漏斗内的液体顺利流出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com