
【题目】常温下,把0.02 mol/L CH3COOH(Ka=1×10-5 mol/L)溶液和0.01 mol/L NaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是
A. c(CH3COO-)>c(Na+) B. c(CH3COOH)>c(CH3COO-)
C. c(H+)<c(OH-) D. c(CH3COOH)+c(CH3COO-)=0.02 mol/L
【答案】A
【解析】
常温下,把0.02 mol/L CH3COOH(Ka=1×10-5 mol/L)溶液和0.01 mol/L NaOH溶液等体积混合,所得溶液中溶质是醋酸钠和醋酸,且物质的量浓度相等,由于溶液等体积混合,所得混合溶液的体积与原单一的溶液来讲,增大到原来的2倍,因此其浓度均为0.005mol/L。醋酸的电离平衡常数是1×10-5 mol/L,则CH3COO-的水解平衡常数是![]() 。
。
A、由于醋酸电离的程度大于醋酸根离子的水解程度,所以c(CH3COO-)>c(Na+),故A正确;
B、由于醋酸电离的程度大于醋酸根离子的水解程度,所以c(CH3COOH)<c(CH3COO-),故B错误;
C、由于醋酸电离的程度大于醋酸根离子的水解程度,所以溶液呈酸性,c(H+)>c(OH-),故C错误;
D、由于溶液等体积混合,所得混合溶液的体积与原单一的溶液来讲,增大到原来的2倍,所以浓度变为![]() ,根据物料守恒,c(CH3COOH)+c(CH3COO-)=0.01 mol/L,故D错误。
,根据物料守恒,c(CH3COOH)+c(CH3COO-)=0.01 mol/L,故D错误。


科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氟、硫是中学常见的非金属元素,铁离子可与由它们组成的SCN﹣,CN﹣,F﹣等形成很多的配合物。
(1)基态Fe原子中,电子占据的最高能层符号为____,该能层具有的原子轨道数为_____,电子数为______。
(2)已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为______,在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是______。
(3)配合物K4[Fe(CN)6]中不存在的作用力_______(填序号)。
A.共价键 B.离子键 C.非极性键 D.配位键
(4)写出一种与SCN﹣互为等电子体的分子_________(用化学式表示),该分子的空间构型为___________________。
(5)肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)△H=-1038.7kJ·mol-1,若该反应中有4mol N-H键断裂,则形成的π键有________mol。
(6)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)X的化学名称为__________。
(2)B单质的结构式为__________;E的气态氢化物的电子式为__________;C与D形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为______________,该物质属于______________(填“离子化合物”或“共价化合物”)。
(3)B、C、E分别与A形成的化合物中最稳定的是__________(写化学式)。
(4)D是同周期简单阳离子中离子半径最__________(填“大”或“小”)的元素。
(5)F的单质在反应中常作________剂(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某两种气态烃组成的混合物,取其2.24L(标准状况下)充分燃烧,得到0.16mol二氧化碳气体和3.6g液态水.据此判断下列分析中不正确的是
A. 此混合气体中可能含有乙烷
B. 此气体中一定含有甲烷
C. 此混合气体中一定不含有丙烷
D. 此气体若是乙烯与甲烷的混合气体,则甲烷与乙烯的体积比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是一种解毒镇痛药。烃A是一种有机化工原料,下图是以它为初始原料设计合成阿司匹林关系图:

已知:(苯胺,苯胺易被氧化)
回答下列问题:
(1)C的结构简式为___________。
(2)反应⑤的反应类型___________,在③之前设计②这一步的目的是___________。
(3)F 中含氧官能团的名称________。
(4)G(阿司匹林)与足量NaOH溶液反应的化学方程式为______________。
(5)符合下列条件的 E 的同分异构体有________种。写出核磁共振氢谱中有五组峰,峰面积之比为 1:2:2:2:1 的结构简式:_______(只写一种)。
a.含—OH b.能发生水解反应 c.能发生银镜反应
(6)利用甲苯为原料,结合以上合成路线和下面所给信息合成下图所示的功能高分子材料(无机试剂任选)。________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
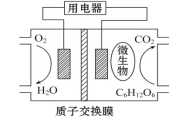
A. 该电池能够在高温下工作
B. 电池的负极反应为C6H12O6+6H2O-24e-====6CO2↑+24H+
C. 放电过程中,H+从正极区向负极区迁移
D. 在电池反应中,每消耗1 mol氧气,理论上能生成CO2气体22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:________,其中电子占据的轨道数为________个。
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为________,羟基间的相互作用力为________。
(3)不同大小的苯芳烃能识别某些离子,如:![]() 、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:______。
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于________晶体,八羰基二钴在液氨中被金属钠还原成四羰基钴酸钠[NaCo(CO)4],四羧基钴酸钠中含有的化学键为_________________。
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为________,C60晶体密度的计算式为________ g·cm-3。(NA为阿伏伽德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种金属单质,B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟。A、B、C、D、E、F间有如下变化关系:

(1)写出A、B、C、E的化学式:
A__________,B__________,C__________,E__________。
(2)写出E→F反应的化学方程式_________;写出B→D反应的化学方程式_________。
(3)F在空气中遇水蒸气产生白雾现象,这白雾实际上是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 双酚A是一种重要的化工原料,它的一种合成路线如下图所示:
双酚A是一种重要的化工原料,它的一种合成路线如下图所示:
 下列说法正确的是
下列说法正确的是
A. 1mol双酚A最多可与2molBr2反应
B. G物质是乙醛的同系物
C. E物质的名称是1-溴丙烷
D. 反应③的化学方程式是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com