
| A. | A2+的半径比B2-的半径小 | B. | A的原子序数比B小 | ||
| C. | A和B原子的电子层数相等 | D. | A和B原子的最外层电子数相等 |
分析 短周期元素的离子A2+和B2-具有相同的电子层结构,则a-2=b+2,A处于第ⅡA族,若A为Mg,则B为O.据此解答.
解答 解:短周期元素的离子A2+和B2-具有相同的电子层结构,则a-2=b+2,A处于第ⅡA族,若A为Mg,则B为O.
A.由上述分析可知,核电荷数A>B,电子层结构相同,核电荷数越大,离子半径越小,所以A2+的半径比B2-的半径小,故A正确;
B.若A为Mg,则B为O,A的原子序数比B大,故B错误;
C.A为Mg,B为O,二者的原子的电子层数不等,故C错误;
D.最外层电子数分别为2、6,故D错误.
故选A.
点评 本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置,清楚元素周期律的递变规律是解答该题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 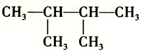 的名称是2,3-甲基丁烷 的名称是2,3-甲基丁烷 | |
| D. | 乙醇可与水以任意比例混溶,是因为与水形成了氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b、a、d、c、e | B. | e、b、a、d、c | C. | b、a、e、d、c | D. | c、d、e、a、b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,等浓度的Na2CO3和NaHCO3溶液的碱性比较,前者更强 | |
| B. | 常温时水溶性:Na2CO3>NaHCO3 | |
| C. | 在酒精灯加热的条件下,前者不分解,后者分解 | |
| D. | 将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇是一种无色无味的液体,可以与水以任意比例互溶 | |
| B. | 1mol乙醇中含有共价键的数目是7NA(NA表示阿伏伽德罗常数的值) | |
| C. | 乙醇与乙二醇、丙三醇互为同系物 | |
| D. | 乙醇可以直接被氧化为乙酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com