
| H2SO4 |
| NH3?H2O |
| △ |
| H2SO4 |
| H2SO4 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
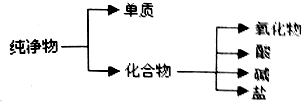 纯净物根据其组成和性质可进行如图所示分类
纯净物根据其组成和性质可进行如图所示分类| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
| B、通入SO2时,SO2与I2反应,I2作还原剂 |
| C、通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| D、滴加KI溶液时,转移2 mol e-时生成1 mol白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液中通入过量的CO2:ClO-+CO2+H2O=HClO+HCO3- | ||||
| B、用碳酸钠溶液吸收Br2:CO32-+Br2+2H2O=Br-+BrO3-+CO2↑+4H+ | ||||
C、用铜电极电解硫酸铜溶液:2Cu2++2H2O
| ||||
| D、已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液,当在Pb(Ac)2醋酸铅溶液中通入H2S时,有黑色沉淀PbS生成:Pb2++2Ac-+H2S=PbS+2HAc |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释后溶液的pH=7 | ||||
| B、氨水的电离度增大,溶液中所有离子的浓度均减小 | ||||
C、稀释过程中
| ||||
| D、pH=11氨水的浓度为0.001mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自然界中没有游离态的硅,纯净的硅晶体可用于制作光导纤维 |
| B、可用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 |
| C、钢材是合金,合金的熔点低,硬度大 |
| D、用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com