
| A、乙醇的沸点低于丁醇;正丁烷的沸点高于异丁烷;并且丁醇的沸点高于丁烷 |
| B、用甘氨酸H2NCH(CH3)CHCOOH和H2NCH(CH3)COOH缩合最多可形成4种二肽 |
| C、乙醛、柠檬酸、甲酸、乙酸甲酯、葡萄糖、麦芽糖都能发生银镜反应 |
| D、C4H8属于烯烃类的同分异构体中存在顺反异构的只有一种 |
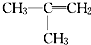 、CH2=CHCH2CH3、CH3CH=CHCH3,只有CH3CH=CHCH3存在的顺反异构为:
、CH2=CHCH2CH3、CH3CH=CHCH3,只有CH3CH=CHCH3存在的顺反异构为: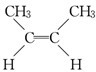 、
、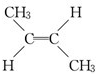 ,故D正确;
,故D正确;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氨水显碱性:NH3?H2O?NH4++OH- |
| B、硫酸氢钠溶液显酸性:NaHSO4=Na++H++SO42- |
| C、Na2S溶液显碱性:S2-+2H2O?H2S+2OH- |
| D、判断反应混乱度变化:X(g)+Y(s)?M(l)+N(g)△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其他条件不变情况下,增加A(g)的质量,则a(A)降低,a(B)升高 |
| B、其他条件不变情况下,增加压强,a(A)升高,则x>3 |
| C、其他条件不变情况下,升高温度,a(A)降低,则△H>0 |
| D、其他条件不变情况下,加入催化剂,则平衡右移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2O) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示是一密闭容器,已知A端盛2.3g金属钠,B端盛有xgHgO,当同时加热容器的两侧支管时,钠着火燃烧,冷却后测得容器中空气成分并未发生变化,求x的值.(Hg的相对原子质量是200.6)
如图所示是一密闭容器,已知A端盛2.3g金属钠,B端盛有xgHgO,当同时加热容器的两侧支管时,钠着火燃烧,冷却后测得容器中空气成分并未发生变化,求x的值.(Hg的相对原子质量是200.6)查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com