
下列说法或表述正确的是________(填序号)。
①(四川理综,4D)将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
②(天津理综,3B)NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
③(重庆理综,3D)25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
④(安徽理综,12D)溶解度小的沉淀易向溶解度更小的沉淀转化,ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀
⑤(江苏,11C)加热0.1 mol·L-1 Na2CO3溶液,CO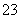 的水解程度和溶液的pH均增大
的水解程度和溶液的pH均增大
⑥(北京理综,9A)测0.1 mol·L-1氨水的pH为11:NH3·H2ONH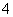 +OH-
+OH-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[H2]m[Cl2]n,式中k为常数,m、n值可用下表中数据确定。
| [H2]/mol·L-1 | [Cl2]/ mol·L-1 | v/mol·L-1·s-1 |
| 1.0 | 1.0 | 1.0 k |
| 2.0 | 1.0 | 2.0 k |
| 2.0 | 4.0 | 4.0 k |
由此可推得,m、n值正确的是( )
A.m=1、n=1 B.m=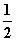 、n=
、n=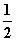
C.m=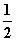 、n=1 D.m=1、n=
、n=1 D.m=1、n=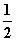
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三个电解池,A池内盛有CuCl2溶液,纯铜片作阴极,B与C两池内均盛有AgNO3溶液,纯银丝作阴极。当B池中银丝质量增加0.108 g、C池中银丝质量增加0.216 g时,A池中铜片质量增加( )
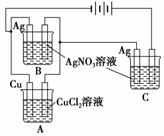
A.0.216 g B.0.108 g
C.0.064 g D.0.032 g
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取SO2的反应原理为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
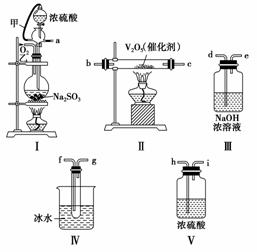
(1)这些装置的连接顺序(按气体从左到右的方向)是________→________→________→________→________→________→________→________(填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是__________________________________________________________
__________________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是__________________________________________________________
__________________________________________________________。
(4)Ⅳ处观察到的现象是__________________________________________________________。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会________(填“增大”、“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国有丰富的锆英石资源,其主要成分是ZrSiO4,还含有Al2O3、SiO2、Fe2O3等杂质,生产锆的流程之一如下:
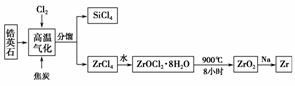
已知:锆(Zr)合金是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。
(1)上述流程中高温气化的反应是氧化还原反应(碳转化成CO),其中氧化剂是________,转移1.204×1024个电子时,生成SiCl4________g。
(2)写出ZrCl4与水反应的化学方程式:______________________,写出ZrOCl2·8H2O在900℃条件下分解的化学方程式:____________________________________。
3下列关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 。
A.1 nm=10-10 m
B.锆合金的硬度比纯锆要高,C.二氧化锆纳米陶瓷是新型无机非金属材料
4一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇Y2O3的氧化锆ZrO2晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向 填“正”或“负”极移动。电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,对pH=3的醋酸溶液(Ⅰ)和pH=11的氢氧化钠溶液(Ⅱ),下列说法正确的是( )
A.Ⅰ和Ⅱ的物质的量浓度均为0.001 mol·L-1
B.将Ⅰ稀释10倍,溶液中c(CH3COOH)、c(OH-)均减小
C.Ⅰ和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量
D.Ⅰ和Ⅱ等体积混合后,溶液中离子浓度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)吸收液吸收SO2的过程中,pH随n(SO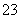 )∶n(HSO
)∶n(HSO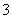 )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:________________________________________________________________________。
(2)当吸收液的pH降至约为6时,需送到电解槽再生。再生示意图如下:
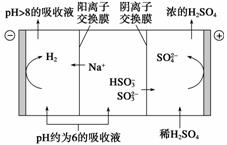
当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O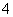 )
)
D.pH相同的①CH3COONa,②NaHCO3,③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,现有0.1 mol·L-1的氨水。请回答下列问题:
(1)为了证明一水合氨(NH3·H2O)是弱电解质,常温下,甲、乙、丙三人分别选用下列试剂进行实验:0.010 mol·L-1氨水、0.1 mol·L-1 NH4Cl溶液,NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
①甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?________(填“是”或“否”),请说明理由:__________________________________________________________
__________________________________________________________。
②乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测出其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测出pH为b,若要确认NH3·H2O是弱电解质,则a、b应满足关系:________________(用等式或不等式表示)。
③丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞试剂,显粉红色,再加入少量NH4Cl晶体,颜色变________(填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质?________(填“能”或“否”),并说明原因:__________________________________________________________
__________________________________________________________。
(2)若向氨水中加入少量硫酸铵固体,此时溶液中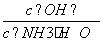 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
(3)若向氨水中加入稀硫酸,二者恰好完全反应后所得溶液的pH________7(填“>”、“<”或“=”),用离子方程式解释原因:__________________________________________________________
__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com