
 配合物种类繁多,应用广泛.按要求完成下列各题:
配合物种类繁多,应用广泛.按要求完成下列各题:分析 (1)配合物也叫络合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成,配位体:提供孤电子对的分子或离子;配位原子:配体中,提供电子对的原子;中心原子、金属原子:一般指接受电子对的原子;配位数:中心原子周围的配位原子个数;
(2)配合物中配位离子Cl-不与Ag+反应,据此计算出外界离子Cl-离子的数目判断;
(3)正八面体结构为对称结构,其中2个CN-被Cl-取代所形成配离子的同分异构体有2种,由配离子结构示意图可知黄血盐的化学式为K4[Fe(CN)6],据此写出化学方程式.
解答 解:(1)[TiCl(H2O)5]Cl2•H2O中,中心离子是Ti3+,提供空轨道接受孤对电子,H2O、Cl-提供孤电子对为配体,2个氨气分子,所以配位数为6,外界是Cl-,内界是:[TiCl(H2O)5]2+,
故答案为:[TiCl(H2O)5]2+;H2O、Cl-;6;
(2)Co显示+3价,配合物显电中性,即配合物中,含有3个Cl-,1mol该配合物生成1mol AgCl沉淀,则1mol该配合物中含1mol外界离子Cl-,即配离子中含有2个Cl-,又由于Co3+配位数为6,则NH3配位数为4,故该配合物的化学式可写为:[CoCl2(NH3)4]Cl或[Co(NH3)4Cl2]Cl,
故答案为:CoCl2(NH3)4]Cl或[Co(NH3)4Cl2]Cl
(3)配合物黄血盐,其配离子呈正八面体结构,正八面体有8个面,每个面都是全等的正三角形,为对称结构,其中2个CN-被Cl-取代所形成配离子的同分异构体有2种,由配离子结构示意图可知黄血盐的化学式为K4[Fe(CN)6],则反应的化学方程式为Fe(CN)2+4KCN=K4[Fe(CN)6],
故答案为:2;Fe(CN)2+4KCN=K4[Fe(CN)6].
点评 本题考查配合物的成键情况,注意配体、中心离子、外界离子以及配位数的判断,把握相关概念,特别注意配体和外界离子的区别,(3)注意正八面体结构的对称性,题目难度中等.


科目:高中化学 来源: 题型:选择题
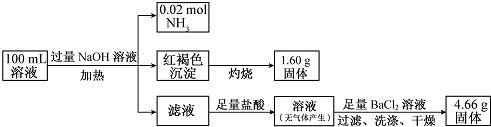
| A. | NH4+、Na+、SO42-一定存在,CO32--定不存在 | |
| B. | NH4+、SO42--定存在,CO32-、Na+-定不存在 | |
| C. | c(Cl-)至少为0.2 mol/L | |
| D. | c(Fe3+)一定为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
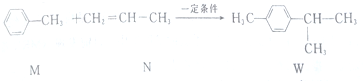 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | M的所有原子可能在同一平面上 | |
| B. | N的二氯代物有5种同分异构体(不考虑立体异构) | |
| C. | W的分子式为C10H14 | |
| D. | M、N和W均能发生氧化反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
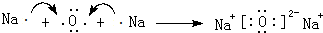 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
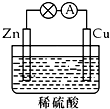
| A. | 铜极上发生氧化反应 | B. | 正极反应为:Cu-2e-=Cu2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 反应一段时间后,溶液的酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| B. | 金属与浓硫酸或浓硝酸反应都不会产生氢气 | |
| C. | 每1 molCu参加反应就有2 mol浓 H2SO4被还原,同时生成2 mol SO2 | |
| D. | 浓硫酸因为有吸水性,可用来干燥HCl、SO2、Cl2等多种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每个53131Cs含有78个中子 | B. | CsOH的碱性比KOH的强 | ||
| C. | HI的还原性比HF的强 | D. | KIO3是碘的最高价含氧酸的盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
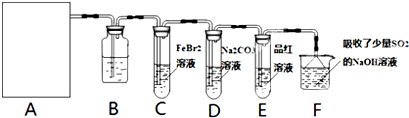
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com