
| A. | 向Al2(S04)3溶液中加入过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++N03-=3Fe3++NO↑+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e一=2MnOOH+2OH- |
分析 A.反应生成氢氧化铝和氯化铵;
B.少量小苏打完全反应,生成碳酸钙、NaOH、水;
C.发生氧化还原反应,四氧化三铁在离子反应中保留化学式;
D.碱性锌锰电池正极得到电子,发生还原反应.
解答 解:A.向Al2(S04)3溶液中加入过量氨水的离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故A错误;
B.澄清石灰水与少量小苏打溶液混合的离子反应为Ca2++OH-+HCO3-=CaCO3↓+H2O,故B错误;
C.磁性氧化铁溶于稀硝酸的离子反应为3Fe3O4+28H++N03-=9Fe3++NO↑+14H2O,故C错误;
D.碱性锌锰电池正极反应为2MnO2+2H2O+2e-=2MnOOH+2OH-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注重学生分析与应用能力、思维严密性训练,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
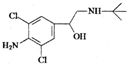
| A. | 该物质的分子式为C12H18ON2Cl2 | |
| B. | 该物质易溶于盐酸 | |
| C. | 该物质的1H核磁共振谱图中有8个吸收峰 | |
| D. | 该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:X>Y | |
| B. | 非金属性:X>Y | |
| C. | 最高价氧化物对应的水化物酸性:X>Y | |
| D. | 原子半径:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是①和④;②和③.(用序号表示)
(1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是①和④;②和③.(用序号表示)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论或实验目的 |
| A | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 溶液中有Na+,无K+ |
| B | 向硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 非金属性:Cl>Si |
| C | 向Ba(NO3)2溶液中通入SO2,有白色沉淀产生 | SO2具有还原性 |
| D | 将含少量KNO3杂质的NaCl晶体制成热的饱和溶液,冷却结晶,过滤 | 除去NaCl中的KNO3杂质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
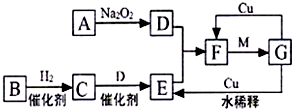 下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体.
下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光伏发电是将化学能转化为电能 | |
| B. | 钢铁吸氧腐蚀正极的电极反应式是O2+4e-+2H2O=4OH- | |
| C. | 通过电解NaCl水溶液的方法生产金属钠 | |
| D. | 铅蓄电池的负极材料是Pb,正极材料是PbSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com