
【题目】某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=﹣48.25kJmol﹣1反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=1.6molL﹣1 , 下列结论正确的是( )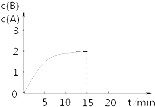
A.该温度下此反应的平衡常数为3.2
B.A的初始物质的量为4 mol
C.反应到达平衡时,放出的热量是193kJ
D.反应达平衡时,A的转化率为80%
【答案】D
【解析】A.浓度变化量之比等于化学计量数之比,故平衡时c(C)=c(B)=1.6molL﹣1,故平衡常数表达式k= ![]() =
= ![]() =4,A不符合题意;
=4,A不符合题意;
B.浓度变化量之比等于化学计量数之比,故△c(A)=2c(B)=2×1.6molL﹣1=3.2molL﹣1,A的起始浓度为3.2molL﹣1+0.8mol/L=4mol/L,故A的初始物质的量为4mol/L×2L=8 mol,B不符合题意;
C.参加反应的A的物质的量为3.2mol/L×2L=6.4mol,故放出的热量为48.25kJ× ![]() =154.4kJ,C不符合题意;
=154.4kJ,C不符合题意;
D.反应达平衡时,c(B)=1.6molL﹣1,减小的A的浓度是3.2mol/L,A的变化浓度是0.8mol/L,平衡时c(A)=0.8mol/L,所以A的初始浓度是4.0mol/L,A的转化率为 ![]() ×100%=80%,D符合题意;
×100%=80%,D符合题意;
所以答案是:D
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).


科目:高中化学 来源: 题型:
【题目】在有机化学反应中,通常把有机物分子中失去氢原子或加入氧原子的反应叫做氧化反应,反之叫做还原反应。工处生产苯乙烯是利用乙苯的脱氢反应:![]() (正反应吸热)。针对上述反应,在其它条件不变时,下列说法正确的是
(正反应吸热)。针对上述反应,在其它条件不变时,下列说法正确的是
A. 该反应属于还原反应 B. 乙苯分子式C8H11
C. 苯乙烯最多16个原子共平面 D. 此逆反应不属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
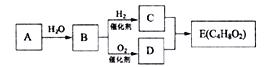
【题目】烃A在一定条件下可以转化为有机物E,其转化关系如下图。已知烃A在标准状况下的密度为116g/L,加热时B与新制氢氧化铜产生砖红色沉淀,E为有浓郁香味、不易溶于水的油状液体。
请回答:
(1)B中官能团的结构简式为_________________________。
(2)C+D→E的化学方程式为___________________________________。
(3)下列说法正确的是______
a.C物质与金属钠反应比水与金属钠反应更剧烈
b.有机物C、D、E可用饱和Na2CO3溶液鉴别
c.实验室制备E时,加入浓盐酸做催化剂
d.B能被酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
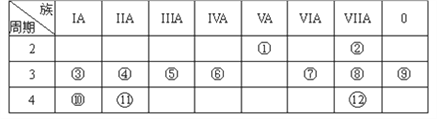
(1)写出元素符号:⑨________(填化学式,下同)
(2)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,呈两性的氢氧化物是________。
(4)写出③和⑧形成的化合物的电子式__________________。
(5)写出④和⑧所构成的化合物的化学键类型__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个由m个氨基酸组成的蛋白质由n条肽链组成,则该蛋白质分子至少含有的氨基和形成的水分子数分别为 ( )
A.n m B.m n C.1 m D.n (m-n)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类及胶体性质描述正确的是 ( )
A.熟石灰、烧碱、纯碱都是碱
B.明矾、漂白粉、硫酸铜均为纯净物
C.“血液透析”和“静电除尘”分别利用了胶体的不同性质
D.纳米材料粒子直径一般从几纳米到几十纳米,因此纳米材料属于胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸埃克替尼片又名凯美纳是我国自主研发的治疗肺癌良药,以下是制备盐酸埃克替尼的其中一条合成路线:
(已知: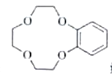 结构片段可以简写为
结构片段可以简写为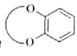 )
)
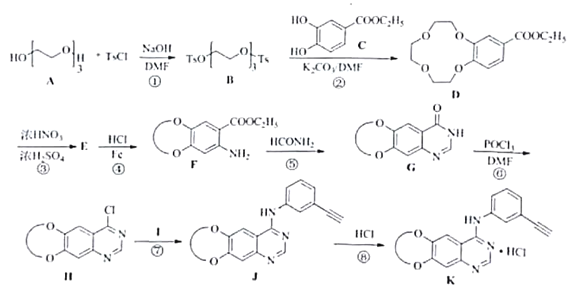
(1)化众物F中含氧官能团名称是_______,________。
(2)反应①⑦的反应类型分别是_________,_________。
(3)化合物Ⅰ的结构简式为_________。
(4)反应③的化学方程式为_________
(5)化介物M是化合物C的同系物,分子式为C8H5O4,其同分异构体有多种,其中同时满足下列三个条件的同分异构体有____种。
①能发生银镜反应
②不含醇羟基
③含有的官能团数目、种类及苯环上取代基数目与化合物C都完全相同。
其中核磁共振氢谱上显示苯环上只有2组峰,峰面积比例为1:2的同分异构体的结构简式为__________。
(6)三缩乙二醇(A)可以由三分子乙二醇在浓硫酸加热条件下缩合得到。请从最简单的烯烃出发,经三步合成三缩乙二醇,请完成合成路线。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带一路”为中国化工企业开辟了新的国际市场,而能源、资源整合及环境治理是保驾护航的基础。
Ⅰ.在能源领域,科学家提出“绿色自由“”构想: 把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
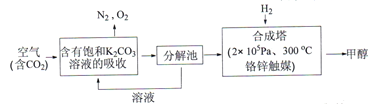
(1)在合成塔中,若有4400gCO2与足量H2完企反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式__________。
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2的转化率随温度变化如下图所示:
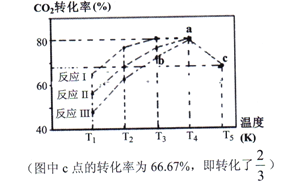
①催化剂效果最佳的反应是__________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)______ v (逆)(填 “>”, “<”, “=”)。
③c点时该反应的平衡常数K =_________。(写单位)
Ⅱ.环境治理中,安装汽车尾气催化转化器的反应是:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)ΔH<0
2CO2(g)+N2(g)ΔH<0
(3)温度升高K值_______(填“增大”或“减小”)
(4)若反应在恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____________。

(5)下列所示装置可以在吸收SO2的同时,用阴极排出的溶液吸收NO2,(电极均为惰性电极)

a极为______极(填“阴”、“阳”),b极的电极反应式为_________,结合电极反应式简述该装置能吸收SO2的原理:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl,用NA表示阿伏伽德罗常数的值,下列说法不正确的是
A. 0.1 mol BaCl2中所含离子总数为0.3 NA
B. 25℃时,0.1mol/L的HCl溶液中含有H+的数目为0.1 NA
C. 标准状况下,17 g H2O2中所含分子总数为0.5 NA
D. 生成2.33 g BaSO4沉淀时,吸收SO2的体积在标准状况下约为0.224 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com