
【题目】下列一句话中叙述了两个值,前者记为![]() ,后者记为
,后者记为![]() ,
,![]() 和
和![]() 的关系从A、B、C、D中选择,并填空。
的关系从A、B、C、D中选择,并填空。
A.![]() B.
B.![]() C.
C.![]() D.无法比较
D.无法比较
(1)常温下![]() 的
的![]() 与
与![]()
![]() 等体积混合后溶液中
等体积混合后溶液中![]() 和
和![]() :______;
:______;
(2)同温度下,![]()
![]() 溶液中
溶液中![]() 水解百分率与
水解百分率与![]() 溶液中
溶液中![]() 的水解百分率:______;
的水解百分率:______;
(3)pH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的![]() 倍和
倍和![]() 倍,稀释后两溶液的
倍,稀释后两溶液的![]() 值仍然相同,则
值仍然相同,则![]() 和
和![]() 的关系是:______;
的关系是:______;
(4)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中![]() :______;
:______;
(5)相同温度下,![]() 值为12的烧碱溶液中水的电离度和
值为12的烧碱溶液中水的电离度和![]() 值为12的
值为12的![]() 溶液中水的电离度:______;
溶液中水的电离度:______;
(6)将![]() 值为2的盐酸和醋酸都稀释相同倍数所得稀溶液的
值为2的盐酸和醋酸都稀释相同倍数所得稀溶液的![]() 值:______;
值:______;
(7)室温下某强酸和某强碱溶液等体积混合后,溶液的![]() 值为7,原酸溶液和原碱溶液的物质的量浓度:______;
值为7,原酸溶液和原碱溶液的物质的量浓度:______;
(8)相同温度下,![]() 的
的![]() 溶液中的
溶液中的![]() 个数和
个数和![]()
![]() 溶液中
溶液中![]() 的个数:______。
的个数:______。
【答案】B B A B B A D A
【解析】
(1)醋酸和醋酸钠的混合液中,醋酸的电离程度大于醋酸根的水解程度,导致溶液显示酸性,c(H+)>c(OH-),根据电荷守恒,所以c(Na+)<c(CH3COO-);
因此,本题正确答案是:B;
(2)溶液越稀,即浓度越小,铁离子的水解程度越大,所以0.1mol/LFeCl3溶液中Fe3+水解百分率小于0.01molL-1FeCl3溶液中Fe3+的水解百分率;
因此,本题正确答案是:B;
(3)醋酸是弱酸,稀释促进电离,在体积增大导致浓度减小的同时还会电离出一部分氢离子,盐酸是强酸,稀释过程中体积增大而导致浓度减小,pH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的pH值仍然相同,则醋酸加水多;
因此,本题正确答案是:A;
(4)碳酸钠溶液中,碳酸根的水解程度随着温度的升高而增大,所以升高温度促进水解,碳酸氢根的浓度增大,故答案为:B;
(5)NaOH电离出OH-抑制水的电离,pH值为12的烧碱溶液中水电离出的氢离子浓度等于溶液中氢离子浓度;醋酸钠电离出的醋酸根水解促进水的电离,pH值为12的CH3COONa溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度,所以相同温度下,pH值为12的烧碱溶液中水的电离度小于pH值为12的CH3COONa溶液中水的电离度;
因此,本题正确答案是:B;
(6)醋酸是弱酸,稀释促进电离,盐酸是强酸,稀释过程浓度减小,所以将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值是盐酸的大于醋酸的;
因此,本题正确答案是:A;
(7)室温下强酸和强碱溶液等体积混合后,溶液的pH值为7,则溶液显示中性,所以原来溶液中氢离子和氢氧根离子的物质的量浓度是相等的,但是酸和碱的元数未知,酸和碱的浓度大小不能确定;
因此,本题正确答案是:D;
(8)两溶液体积相等,前者物质的量浓度大于后者,氯化铵溶液中,铵根离子水解,铵根离子浓度越大水解程度越小,即相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数大于1L 0.5molL-1NH4Cl溶液中NH4+的个数;
因此,本题正确答案是:A;


科目:高中化学 来源: 题型:
【题目】化学平衡常数![]() 、电离常数(Ka、Kb)、溶度积常数
、电离常数(Ka、Kb)、溶度积常数![]() 等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A. 当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)和溶度积常数![]() 一定均变大
一定均变大
B. ![]() 说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C. 向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生![]() 沉淀,则
沉淀,则![]()
D. 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象及结论均正确的是
实验操作、现象 | 结论 | |
A | 取1 mL 20%的蔗糖溶液,加入3~5滴稀硫酸。水浴加热5 min后取少量溶液,加入少量新制Cu(OH)2,加热,无砖红色沉淀产生 | 蔗糖没有发生水解 |
B | 向装有溴水的分液漏斗中加入裂化汽油,充分振荡并静置,下层为橙色 | 裂化汽油可以萃取溴 |
C | 将SO2通入紫色石蕊溶液中,溶液先变红后褪色 | SO2是酸性氧化物,还具有漂白性 |
D | 分别向盛有KI3溶液的a、b试管中滴加淀粉溶液、AgNO3溶液,a中溶液变蓝,b中产生黄色沉淀 | 溶液中存在:I3- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(![]() )广泛存在于食品中,人们对其及相关产品进行了深入研究。
)广泛存在于食品中,人们对其及相关产品进行了深入研究。
(1)已知![]() 时,
时,![]() :
:![]() ,
,![]() 溶液显酸性。解释
溶液显酸性。解释![]() 溶液显酸性的原因:______;(用化学用语并配以必要文字说明)
溶液显酸性的原因:______;(用化学用语并配以必要文字说明)
(2)已知反应:![]() ,为了使草酸分解,通过
,为了使草酸分解,通过![]() 燃烧反应提供能量:
燃烧反应提供能量:![]() ,已知分解的草酸与所需空气(其中氧气的体分数为
,已知分解的草酸与所需空气(其中氧气的体分数为![]() )的物质的量之比为
)的物质的量之比为![]() ,则
,则![]() ______
______
(3)草酸分解生成的![]() 燃料燃烧不足以提供足够的能量,还可通过甲烷来制备
燃料燃烧不足以提供足够的能量,还可通过甲烷来制备![]() 。在密闭容器中通入物质的量浓度均为
。在密闭容器中通入物质的量浓度均为![]() 的
的![]() 和
和![]() ;在一定条件下发生反应
;在一定条件下发生反应![]() ,测得
,测得![]() 的平衡转化率与温度、压强的关系如下图1所示。
的平衡转化率与温度、压强的关系如下图1所示。

①由图判断压强![]() 、
、![]() 、
、![]() 、
、![]() 由小到大的顺序为:______;该反应的
由小到大的顺序为:______;该反应的![]() ______0(填“<”“>”“=”):
______0(填“<”“>”“=”):
②![]() 该反应的平衡常数为______(结果保留两位小数)
该反应的平衡常数为______(结果保留两位小数)
(4)常温下,向![]() 的
的![]() 溶液中逐滴加入
溶液中逐滴加入![]()
![]() 溶液,所得滴定曲线如图所示。下列说法正确的是______
溶液,所得滴定曲线如图所示。下列说法正确的是______
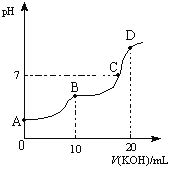
①![]() 点时:
点时:![]()
②![]() 点时:
点时:![]()
③![]() 点时:
点时:
④![]() 点时:
点时:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N原子最高能级的电子云轮廓图形状是__________,其核外有______种不同运动状态的电子。
(2)第一电离能N_____O(填“>”“<”或“=”),其原因是_______________________。
(3)在高压下氮气会发生聚合得到高聚氮。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。高聚氮的晶体类型是__________,氮原子的杂化轨道类型为__________。
(4)六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,但石墨可以导电而六方BN却不能导电,其原因是_____________________________。
(5)叠氮酸(HN3)在生产生活中有着重要应用。叠氮酸(HN3)可用HNO2氧化肼(N2H4)制得,化学方程式是N2H4 + HNO2=HN3 + 2H2O。下列叙述错误的是_________。
A.HN3和N2H4都是由极性键和非极性键构成的非极性分子
B.NaN3的晶格能大于KN3的晶格能
C.HN3分子中四个原子可能在一条直线上
D.叠氮酸(HN3)和水能形成分子间氢键
(6)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比是__________(填最简整数比);已知该晶体的晶胞参数为a nm,阿伏加德罗常数的值为NA,则该晶体的密度是_______ g![]() cm-3(用含a和NA的代数式表示)。
cm-3(用含a和NA的代数式表示)。
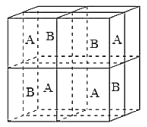
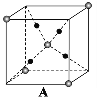
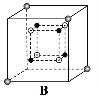
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵受热分解的反应方程式为![]()
![]()
![]() ,用
,用![]() 表示阿伏加德罗常数的值。下列说法不正确的是 ( )
表示阿伏加德罗常数的值。下列说法不正确的是 ( )
A. 1 L 0.1 mol·L1![]() 溶液中Fe2+的数目小于0.1
溶液中Fe2+的数目小于0.1![]()
B. 将1 mol ![]() 和1 mol
和1 mol ![]() 充分反应后,其分子总数为1.5
充分反应后,其分子总数为1.5![]()
C. 标准状况下,每生成15.68 L气体转移电子数目为0.8![]()
D. 常温常压下,3.0 g![]() 中含有的中子总数为1.6
中含有的中子总数为1.6![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaAs晶体的熔点很高, 硬度很大, 密度为ρ g·cm-3,Ga 和As 的摩尔质量分别为MGag·mol-1和MAs g·mol-1, 原子半径分别为rGa pm 和rAs pm, 阿伏加德罗常数值为NA, 其晶胞结构如下图所示, 下列说法错误的是
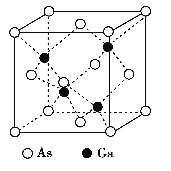
A. 该晶体为原子晶体
B. 在该晶体中,Ga和As均无孤对电子,Ga和As的配位数均为4
C. 原子的体积占晶胞体积的百分率为![]()
D. 所有原子均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com