
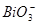 +2Mn2++14H+=5Bi3++2
+2Mn2++14H+=5Bi3++2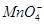 +7H2O
+7H2O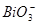 把Mn(NO3)2氧化成
把Mn(NO3)2氧化成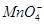 ,本身被还原成Bi3+,离子方程式:5
,本身被还原成Bi3+,离子方程式:5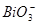 +2Mn2++14H+=5Bi3++2
+2Mn2++14H+=5Bi3++2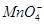 +7H2O。根据实验②和③,H2O2能还原
+7H2O。根据实验②和③,H2O2能还原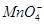 ,而PbO2又把
,而PbO2又把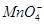 的还原产物氧化成
的还原产物氧化成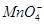 ,所以氧化性PbO2>KMnO4>H2O2;向含有
,所以氧化性PbO2>KMnO4>H2O2;向含有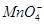 的溶液中通入SO2气体,由于SO2还原性较强,所以紫红色褪去,生成PbSO4白色沉淀。根据电子守恒得:
的溶液中通入SO2气体,由于SO2还原性较强,所以紫红色褪去,生成PbSO4白色沉淀。根据电子守恒得: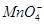 ~ 5O2
~ 5O2

科目:高中化学 来源:不详 题型:单选题
| A.Cu2+ | B.Fe3+ | C.Fe2+ | D.H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2Fe3++SO2+2H2O===2Fe2++SO +4H+ +4H+ |
| B.I2+SO2+2H2O===H2SO4+2HI |
| C.2Fe2++I2===2Fe3++2I- |
| D.H2O2+SO2===H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Sn2+、Fe2+、Ce3+ | B.Sn2+、Ce3+、Fe2+ |
| C.Ce3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ce3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| | 选用试剂 | 实验现象 |
| 方案1 | | |
| 方案2 | | |
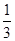 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两个实验中溶液的pH变化趋势相同 |
| B.两实验中生成等量I2时,转移电子数的物质的量相同 |
| C.在实验Ⅰ的过程中,若NaHSO3初始量为3mol,当溶液中I¯与I2的物质的量之比为5∶2时,氧化产物为3.2mol |
| D.过程Ⅱ中,可以用淀粉作为滴定指示剂,判定第一阶段的反应终点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水层显棕黄色 | B.水层无色 | C.四氯化碳层显红棕色 | D.四氯化碳层无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com