
【题目】2丁烯(CH3—CH = CH—CH3)是石油裂解的产物之一,回答下列问题:
(1)在催化剂作用下,2丁烯与氢气反应生成正丁烷,正丁烷的结构简式为 ,正丁烷的同分异构体的系统命名为_____________。
(2)写出2丁烯与溴的四氯化碳溶液反应的化学方程式:_______________,
写出在一定条件下合成聚2丁烯的化学方程式 。
(3)2-丁烯存在着顺、反异构现象,写出反-2-丁烯的结构简式 。
(4)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,烯烃A分子中共平面的原子最多有________个。
(5)研究表明烯烃可发生复分解反应。烯烃的复分解反应指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程。如两分子烯烃RCH=CHR'用上述催化剂作用会生成两种新的烯烃RCH=CHR和R'CH=CHR'。写出在催化剂作用下,(4)中的两个烯烃A分子发生复分解反应的化学方程式 。
【答案】(1) CH3CH2CH2CH3 2-甲基丙烷
(2) CH3CH=CHCH3+Br2→CH3CHBrCHBrCH3 nCH3—CH=CH—CH3![]()
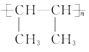
(3) 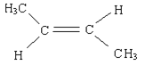 (4)8(5) 2 CH2=C(CH3)2
(4)8(5) 2 CH2=C(CH3)2 ![]() CH2=CH2 + (CH3)2C=C(CH3) 2
CH2=CH2 + (CH3)2C=C(CH3) 2
【解析】
试题分析:(1)在催化剂作用下,2丁烯与氢气反应生成正丁烷,正丁烷的结构简式为CH3CH2CH2CH3,正丁烷的同分异构体的结构简式为(CH3)2CHCH3系统命名为2-甲基丙烷。
(2)2丁烯与溴的四氯化碳溶液反应的化学方程式:CH3CH=CHCH3+Br2→CH3CHBrCHBrCH3
2丁烯在一定条件下合成聚2丁烯的化学方程式nCH3—CH=CH—CH3![]()
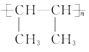
(3)2-丁烯存在着顺、反异构现象,反-2-丁烯的结构简式![]() 。
。
(4)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,烯烃A为2-甲基丙烯,分子中共平面的原子最多有8个。
(5)两分子2-甲基丙烯发生复分解反应的化学方程式2 CH2=C(CH3)2 ![]() CH2=CH2 + (CH3)2C=C(CH3) 2。
CH2=CH2 + (CH3)2C=C(CH3) 2。


科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
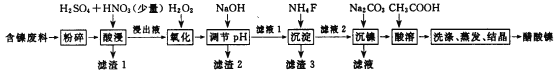
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
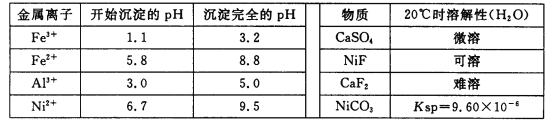
(1)调节pH步骤中,溶液pH的调节范围是____________。
(2)滤渣1和滤渣3主要成分的化学式分别是____________、_____________。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式_____________。
(4)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式_______________。
(5)沉镍过程中,若c(Ni2+)=2.0 mol· L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为______g。(保留小数点后1位有效数字)
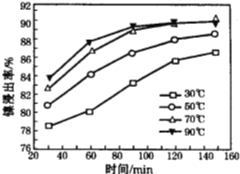
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为________℃、_______min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的许多金属能形成配合物。科学家通过X射线测得胆矾结构示意图可简单表示如下: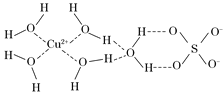
(1)Cu基态原子的外围电子排布为 ,Cr基态原子的外围电子排布为 ,这样排布的理由是_____________________。
(2)NH3是一种很好的配体,原因是______________________。
(3)图中虚线表示的作用力为________________。
(4)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在该晶体中,含有的原子团或分子有:[Cu(NH3)4]2+、NH3、SO42-、H2O,其中[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团或分子是__________,写出一种与此正四面体结构互为等电子体的分子的分子式 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。Ni(CO)4易溶于________(填标号)。
A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,六种元素价电子数之和为26,原子半径依Y、Z、M、N、Q、X依次减小。依据信息,回答下列问题:
(1)Q的核外电子排布图为 。
(2)除X外,其余元素的第一电离能由小到大的顺序为 (用元素符号作答)。
(3)固体A是由以上六种元素中的某些元素组成的离子晶体,结构类似于CsCl,组成中含M元素的质量分数为73.7%,A所有原子的最外层都满足稀有气体原子结构,A受热分解可生成两种单质气体。写出A的电子式 ,常温下A与水反应的化学方程式为 。
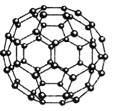
(4)Z元素形成的另一种分子晶体结构如图所示,Z60分子是由60个Z原子构成的,形状酷似足球,有32个面,其中12个面为正五边形,20个面为正六形。Z60分子可与Q元素形成的单质Q2发生加成反应,则加成产物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备溴苯的实验装置如右图所示,请回答下列问题:
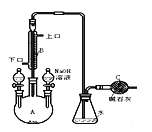
(1)反应开始前已向仪器A中加入的固体药品是铁粉,则装在左侧分液漏斗中的液体药品是 。
(2)写出实验室制溴苯的化学方程式 。
(3)该反应装置中冷凝管B有上、下两个口,冷却水应从 口进入(填“上”或“下”)。
(4)右侧分液漏斗中的物质在 加入A中(填“反应前”、“反应中”或“反应后”),用离子方程式表示其作用是 。
(5)C中碱石灰的作用是 。
(6)该过程可以如下表述:3Br2+2Fe=2FeBr3 ; Br2+FeBr3=FeBr4-+Br+ (不稳定) ;
![]() +Br+→[
+Br+→[![]() ] ; [
] ; [![]() ]+FeBr4-→
]+FeBr4-→![]() +HBr+FeBr3 。
+HBr+FeBr3 。
由上述反应可推知:![]() +Br2 →
+Br2 → ![]() +HBr 中的催化剂为 。(填字母)
+HBr 中的催化剂为 。(填字母)
A. Br2 B.FeBr3 C.Br+ D.FeBr4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:
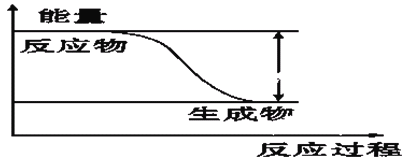
(1)该反应为 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是 (填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜片上产生的现象为 。溶液中SO42-向 极(填“贴片”或“铜片”),外电路中电子 移动。(填“由铁片向铜片”或“由铜片向铁片”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
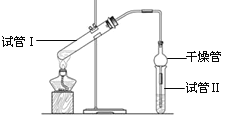
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: 。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
① 实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1 。
② 分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】人工合成有机化合物H的路线可简单表示如下:
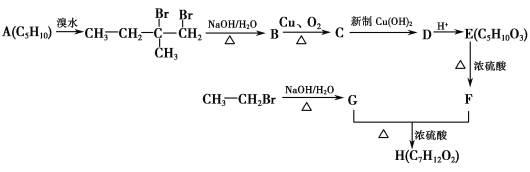
已知:F的核磁共振氢谱有四个峰,峰的面积比为1∶1∶3∶3。
请回答下列问题:
(1)A的名称(系统命名)为________;C中官能团的结构简式为_______________________。
(2)G+F―→H的反应类型为________;H的结构简式为________。
(3)C―→D的离子方程式为___________________________________________ 。
(4)E在一定条件下生成的高分子化合物的结构简式为________________________________。
(5)X是F的同分异构体,它同时符合下列3个条件:①能发生水解反应;②不含甲基;
③能发生银镜反应。则X可能的结构简式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C+和B3-具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的原子个数为1:1的化合物,是人们生活的必需品。回答下列问题:
(1)五种元素中,原子半径最大的是______,非金属性最强的是______(填元素符号)。
(2)由A和D、E所形成的共价型化合物中,热稳定性差的是________(用化学式表示)。
(3)A和E形成的化合物与A和B形成的化合物反应,所得产物中存在的化学键类型为_______。用电子式表示A和B其形成化合物过程________________________________________。
(4)D最高价氧化物的水化物的化学式为____________。
(5)将单质E通入氯化亚铁溶液时,反应的离子方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com