
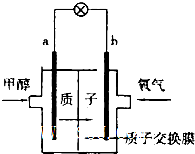
 某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:

科目:高中化学 来源: 题型:
| A、2 | B、3 | C、5 | D、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+ H+ Fe2+ NO3- |
| B、H+ Al3+ SO42- Cl- |
| C、Na+ Al3+ HCO3- Cl- |
| D、Na+ NH4+ OH- CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH变大 |
| B、c(Na+)与c(CO32-)的比值变大 |
| C、溶液浓度变大,有晶体析出 |
| D、实质是电解水,有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
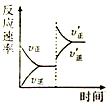 一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )| A、正反应是放热反应 |
| B、逆反应是放热反应 |
| C、m+n<p+q |
| D、m+n>p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,溶液的pH降低 |
| B、c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、加入少量NaOH固体,c(CO32-)与c(Na+)均增大 |
| D、c(Na+)+c(H+)=2c(CO32-)+2c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在放电时,电池中硫酸的浓度不断变小 |
| B、在放电时,正极发生的反应是Pb(s)+SO42-(aq)=PbSO4(s)+2e- |
| C、在充电时,电池中阴极质量不断变小 |
| D、在充电时,阳极发生的反应是 PbSO4(s)+2e-=Pb(s)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500mL2mol?L-1稀硫酸 |
| B、150mL5mol?L-1稍酸 |
| C、50mL3mol?L-1盐酸 |
| D、500mL2mol?L-1稀硫酸和少量硫酸铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com