
| A. | 煤的气化和液化是高效、清洁地利用煤炭的重要途径 | |
| B. | 蚕丝的主要成分是纤维素 | |
| C. | pH小于7.0的降雨通常称为酸雨 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水污染 |
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(标准状况) |
| ③ | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g;第二次称量读数为2.33g |
| 阴离子符号 | 物质的量浓度/mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
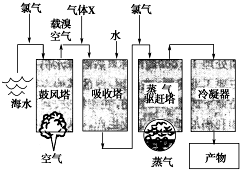 如图所示是以海水为原料,获得某产物的工艺流程图.已知在吸收塔中,溶液的pH显著减小.请回答下列问题:
如图所示是以海水为原料,获得某产物的工艺流程图.已知在吸收塔中,溶液的pH显著减小.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向澄清石灰水中加入过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 向Ca(ClO2)溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
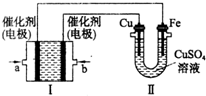 如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.
如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| B. | 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+Ba2-+2OH-=BaCO3↓+NH3•H2O+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| D. | 用惰性电极电解氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.36mLNaOH 溶液 | |
| B. | 用托盘天平称取6.85g食盐 | |
| C. | 用标准的盐酸滴定未知浓度的NaOH 溶液,用去盐酸21.10mL | |
| D. | 用广泛pH 试纸测得某溶液pH 为5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水的物质的量浓度等于氢氧化钠溶液 | |
| B. | 将氨水体积稀释10倍,pH<11 | |
| C. | 等体积氨水和氢氧化钠溶液与足量氯化铁溶液反应,氨水产生的沉淀多 | |
| D. | 将等体积的氨水和氢氧化钠用稀盐酸完全中和,消耗盐酸的体积相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com