
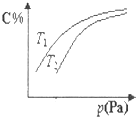
 在密闭容器中,对于可逆反应2A+3B?2C(g) 平衡时C的体积分数与温度和压强的关系如图所示,下列说法不正确的是( )
在密闭容器中,对于可逆反应2A+3B?2C(g) 平衡时C的体积分数与温度和压强的关系如图所示,下列说法不正确的是( )| A. | 若正反应方向△H<0,则T2<T1 | |
| B. | 压强增大时,混合气体的平均相对分子质量增大 | |
| C. | A不一定为气体 | |
| D. | B一定为气体 |
分析 采取定一议二方式解答,由图可知,温度一定时,压强越大,C的含量越大,故增大压强平衡向正反应移动,故B一定为气体;压强一定时,温度越高,平衡向吸热方向移动,根据C的含量变化结合选项判断反应热与温度高低.
解答 解:A、若正反应方向△H<0,升高温度,平衡向逆反应移动,C的含量降低,由图可知,温度T2到达平衡时C的含量较低,故温度T2>T1,故A错误;
B、温度一定时,压强越大,C的含量越大,平衡向正反应方向移动,A、B至少有一种气体,而A的化学计量数等于C,故B一定为气体,若均为气体,混合气体总质量不变,总的物质的量减少,平均相对分子质量增大,若A为非气态,平衡正向移动,混合气体的总质量增大,总的物质的量减少,故平均相对分子质量增大,故B正确;
C、由C中的分析可知,B一定是气体,A可能是气体,可能为非气体,故C正确;
D、温度一定时,压强越大,C的含量越大,故增大压强平衡向正反应移动,正反应是气体体积减小的反应,即B一定是气体,故D正确;
故选A.
点评 本题考查外界条件对化学反应速率、化学平衡移动影响、学生识图能力,难度不大,做题时注意分析图象曲线的变化特点,采取定一议二解答.


科目:高中化学 来源: 题型:解答题


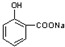 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某
超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体 | B. | 分子晶体 | C. | 原子晶体 | D. | 金属晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应情况设想 | 评价 |
| A | 当铁、铜均不剩余时,溶液中一定有Fe2+、Cu2+,一定无Fe3+ | 正确,Fe3+和Fe、Cu均可反应 |
| B | 当铁、铜均有剩余时,溶液中一定有Fe2+、Cu2+,无Fe3+ | 正确,Fe和Cu与Fe3+都反应,故有Fe2+和Cu2+,无Fe3+ |
| C | 当铜有剩余,铁无剩余时,溶液中一定只有Fe2+,无Cu2+ | 正确,Cu有剩余,故无Cu2+ |
| D | 当铁有剩余,铜无剩余时,溶液中一定有Fe2+、Cu2+ | 不正确,不可能有Fe剩余,而铜不剩余,因为Fe比Cu优先于Fe3+反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com