
科目:高中化学 来源: 题型:
I.在500 ℃、2×107 Pa和催化剂条件下合成氨工业的核心反应是:N2(g)+3H2(g) 2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题:
2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题:
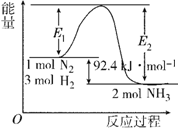
(1) 在500 ℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_____(填“<”“>”或“=”)46.2 kJ,理由是_____________________。
(2) 将一定量的H2(g)和N2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。则该条件下达到平衡时H2的转化率为________。该温度下的平衡常数K的值为________。若升高温度,K值________(填“增大”“减小”或“不变”)。
II.一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s) + H2O(g)  CO(g) + H2(g)
CO(g) + H2(g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均分子量为M,则M的范围为
(2)在(1)中若起始时充入的是2.5 molCO(g) 和4 mol H2(g),达到平衡后混合气体的平均相对分子质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分
 进行测量。先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品
进行测量。先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品
开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
⑴ 根据电子天平读数和时间的关系分析,该反应进行过程中,
氢气的产生速度有什么特点?
⑵ 完全反应后,烧杯中盐的质量分数为多少?(用百分数表示)
⑶ 合金中铁元素的质量百分含量为多少?
| 空烧杯 | 加入 硫酸后 | 加入铁粉后5分钟 | 加入铁粉 | 加入铁粉后21分钟 | 加入铁粉后40分钟 | 加入铁粉后3小时 | |
| 读数(g) | 28.5 | 169.7 | 183.6 | 183.5 | 183.4 | 183.3 | 183.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲乙丙丁四种物质,在一定的条件下充分反应,测得反应前后各物质的质量分数
如图所示。下列说法正确的是

A.丙一定是这个反应的催化剂
B.该反应可能是分解反应
C.甲一定是化合物,乙一定是单质
D.参加反应的甲的质量一定等于生成的丁和乙的质量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
KNO3与KCl的溶解度曲线如左下图所示,请回答下列问题:
(1)t1℃时,将50g KNO3加入 g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液的溶质质量分数,可进行的操作是 ;
(2)KNO3溶液中含有少量KCl时,可通过 的方法提纯;
(3)在一定温度下,向100克水中依次加入一定质量的KCl固体,充分溶解,所加KCl的质量与得到相应溶液的质量关系如右下图所示:
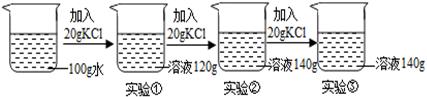

Ⅰ.实验②的溶液是否为饱和溶液? (填“是”、“不是”或“无法判断”);
Ⅱ.实验①、②、③所得溶液的溶质质量分数分别表示为a%、b%、c%,则a、b、c的大小关系是 (用“>”、“<”或“=”表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在烧杯中的盛有10g H Cl和BaCl2溶液,向其中逐滴滴入溶质质量分数为13.25%
Cl和BaCl2溶液,向其中逐滴滴入溶质质量分数为13.25%
的碳酸钠溶液。测得溶液pH与加入的碳酸钠溶液的质量关系如图所示。
(1)通过图中可知,当碳酸钠溶液质量加到 g时,溶液中盐酸恰好完全反应。
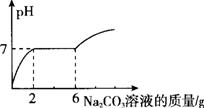 (2)请计算原烧杯溶液中氯化钡的质量分数。
(2)请计算原烧杯溶液中氯化钡的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关阳离子的说法中错误的是( )
①阳离子都是由一个金属原子失去电子而形成的 ②非金属原子不能形成阳离子 ③阳离子的电子排布一定与稀有气体元素原子相同 ④阳离子的价态不会大于其原子的最外层电子数 ⑤阳离子都是稳定结构,不会再失去电子
A.①④ B.②④
C.①②③ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
酸、碱、盐溶液能够导电,是因为物质溶于水时,离解成为自由移动的阴、阳离子。
(1)在酸的溶液里,酸根离子所带________的总数等于酸电离时生成的________的总数;在碱的溶液里,跟金属离子结合的________的总数等于这种金属离子所带的________的总数;在盐的溶液中,金属离子所带的________的总数等于酸根离子所带的________的总数。
(2)下列物质的电离方程式如下:
HClO4===H++ClO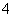 ;
;
Ba(OH)2===Ba2++2OH-;
Fe2(SO4)3===2Fe3++3SO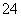 ;
;
KHSO4===K++H++SO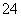 。
。
属于酸的物质________(写化学式);属于碱的物质为________;属于盐的物质________。
(3)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是________。
②上述物质中既不是电解质也不是非电解质的是________。依据是________________________。
③写出纯碱的电离方程式______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com