
| NaOH的质量分数 | 阳极析出物质的质量/g | 阴极析出物质的质量/g | |
| A | 0.062(6.2%) | 19 | 152 |
| B | 0.062(6.2%) | 152 | 19 |
| C | 0.042(4.2%) | 1.2 | 9.4 |
| D | 0.042(4.2%) | 9.4 | 1.2 |
| A、A | B、B | C、C | D、D |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:

2- 4 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2:向A试管中滴加1~2滴 | 若溶液 否则,则假设2或3成立. |
| 步骤3:向B试管中滴加1~2滴 | 若溶液 否则,结合步骤2,则假设2成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烃及烃的含氧衍生物的相对分子量均为奇数 |
| B、硝基化合物的相对分子量均是偶数 |
| C、烃及烃的含氧衍生物的相对分子量均为偶数 |
| D、酚、醛、氨基酸、酯的相对分子量均为偶数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
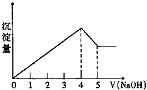 有一镁、铝合金,用适量稀硫酸完全溶解,再加入氢氧化钠溶液,析出沉淀的质量随氢氧化钠的体积关系如图所示,原合金中镁、铝质量比为( ) (Mg、Al的相对原子质量分别为24、27)
有一镁、铝合金,用适量稀硫酸完全溶解,再加入氢氧化钠溶液,析出沉淀的质量随氢氧化钠的体积关系如图所示,原合金中镁、铝质量比为( ) (Mg、Al的相对原子质量分别为24、27)| A、4:3 | B、4:9 |
| C、8:9 | D、20:27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥ | B、①②④ |
| C、①②④⑥ | D、②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com