
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
分析 饱和醇(X)与足量乙酸反应生成酯(Y),设醇中羟基数目为n,则Mr(醇)+n×Mr(乙酸)=Mr(酯)+n×Mr(水),故Mr(酯)-Mr(醇)=n×Mr(乙酸)-n×Mr(水)=42,即60n-18n=42,解得n=1,再根据醇的相对分子质量为90,饱和一元醇的通式CnH2n+2O求出分子式,该醇可由烯烃与水在一定条件下反应制得,说明与羟基所连碳原子相邻的碳原子上有氢原子来解答.
解答 解:饱和醇(X)与足量乙酸反应生成酯(Y),设醇中羟基数目为n,则Mr(醇)+n×Mr(乙酸)=Mr(酯)+n×Mr(水),故Mr(酯)-Mr(醇)=n×Mr(乙酸)-n×Mr(水)=42,即60n-18n=42,解得n=1,
饱和一元醇的通式CnH2n+2O,醇的相对分子质量为90,所以醇的分子式为C5H12O,与羟基所连碳原子相邻的碳原子上有氢原子,则有:HOCH2CH2CH2CH2CH3、HOCH(CH3)CH2CH2CH3、HOCH(CH2CH3)2、HOCH2CH(CH3)CH2CH3、HOC(CH3)2CH2CH3、HOC(CH3)CH(CH3)2、HOCH2CH2CH(CH3)2,
故选B.
点评 本题考查有机物的推断、同分异构体的书写等,难度中等,注意确定的方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
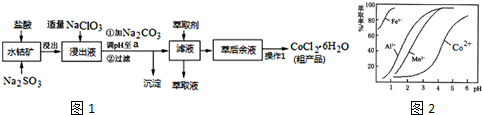
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计 | 观察或记录 | 结论或解释 |
| A | 将浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 浓硝酸的还原产物是NO2 |
| B | 测某铵盐溶液的pH | pH>7 | NH4+水解生成NH3•H2O,使溶液显碱性 |
| C | 用湿润的淀粉碘化钾试纸检验某气体 | 试纸变蓝 | 该气体一定是Cl2 |
| D | 将盛少量水的分液漏斗静置、倒置、将塞子旋转1800后再次倒置 | 漏斗口和活塞不漏水 | 分液漏斗不漏液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | |
| A | 加入NaOH溶液 | 有红褐色沉淀 |
| B | 加入Ba(NO3)2溶液 | 有白色沉淀 |
| C | 加入酸性KMnO4溶液 | 紫色褪去 |
| D | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 乙醇反应时断键部位 | B | 基团的相互影响 |
 (1)和浓硫酸共热到170℃时②⑤断键 (2)和浓硫酸共热到140℃时只断键② | (1)与钠反应时乙醇比水慢,说明受乙基影响,醇羟基中H原子活泼性减弱 (2)苯酚浊液中加Na0H溶液变澄清,说明受苯环影响,酚羟基中H原子活泼性增强 | ||
| C | 分离提纯 | D | 醇、酚用途 |
| (1)工业乙醇通过蒸馏得无水乙醇 (2)苯中混有苯酚,加溴水沉淀后过滤,除去三溴苯酚沉淀 | (1)甘油加水作护肤剂 (2)酚类化合物有毒,不能用于杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有醇都能发生催化氧化、消去反应 | |
| B. | 低级醇(甲醇、乙醇、丙醇、乙二醇)都能与水以任意比互溶 | |
| C. | 凡烃基直接和羟基相连的化合物一定是醇 | |
| D. | 乙醇和浓硫酸按1:3体积比混合、共热就一定产生乙烯. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| B. | 地沟油的主要成分是高级脂肪酸甘油酯.可用于制肥皂 | |
| C. | 石油分馏的目的是为了获得乙烯、丙烯和1,3-丁二稀 | |
| D. | 乙醇,过氧化氢和臭氧可用于消毒.均体现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 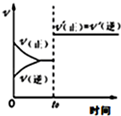 反应CO+NO2?CO2+NO达平衡后,增大压强时反应速率随时间的变化 | |
| B. | 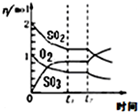 反应2SO2+O2?2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 | |
| C. | 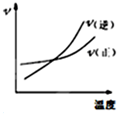 反应N2+3H 2?2NH3△H<0在恒容的容器中,反应速率与温度的关系 | |
| D. | 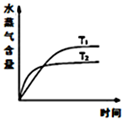 反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,温度分别为T 1、T 2时水蒸气含量随时间的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com