
【题目】(1)1.7g氨气在标准状况下的体积是_____________升,共含有_____________mol电子;0.1mol硫化氢共含有_____________个质子,同质量的氨气和硫化氢气体中分子个数比为_____________,含氢原子的个数比为_____________。在标准状况下硫化氢的密度为_____________。
(2)在标准状况下,18gCO和CO2的混合气体完全燃烧后得到11.2LCO2,则原混合气体的密度是_____________,原混合气体中,CO的质量是_____________,CO2的体积是_____________碳原子和氧原子的个数比为_____________。
【答案】2.24 1 1.08×1024(或1.8NA) 2:1 3:1 1.52gL-1 1.6g/L 7 5.6L 2:3
【解析】
(1)氨气的摩尔质量为17g/mol,由n=![]() =
=![]() =0.1mol,则标况下V=nVm=0.1mol×22.4L/mol=2.24L,含有的电子为0.1mol×10=1mol;
=0.1mol,则标况下V=nVm=0.1mol×22.4L/mol=2.24L,含有的电子为0.1mol×10=1mol;
0.1mol硫化氢含有质子数为0.1mol×(1×2+16)×NA=1.8×6.02×1023(或1.8NA),
硫化氢的摩尔质量为34g/mol,同质量的氨气和硫化氢的物质的量之比为:=2:1,
则同质量的氨气和硫化氢气体中分子个数比为2:1,
含氢原子个数比为2×3:1×2=3:1,
由ρ=![]() 可知标准状况下硫化氢的密度为ρ=
可知标准状况下硫化氢的密度为ρ=![]() =1.52gL-1,
=1.52gL-1,
故答案为:2.24;1;1.08×6.02×1024(或1.8NA);2:1;3:1;1.52gL-1;
(2)混合气体的密度=![]() =1.6g/L,令CO和CO2的物质的量分别为xmol、ymol,根据二者质量及体积,则:
=1.6g/L,令CO和CO2的物质的量分别为xmol、ymol,根据二者质量及体积,则: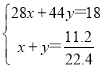
解得x=0.25,y=0.25,
原混合气体中,CO的质量是0.25mol×28g/mol=7g,
标况下,CO2的体积是0.25mol×22.4L/mol=5.6L,
碳原子和氧原子的个数比为(0.25mol+0.25mol):(0.25mol+0.25mol×2)=2:3,
故答案为:1.6g/L;7;5.6L;2:3。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
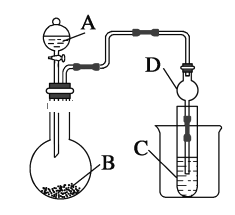
【题目】利用下图装置可以验证非金属性的变化规律。
(1)仪器A的名称为________,球形管D的作用是________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为____________________________________________________________。
(3)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. MnO2固体与浓盐酸反应制取Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
D. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO在橡胶、塑料、涂料工业有重要应用,工业上用含锌物料(含FeO、CuO等杂质)制取活性ZnO的流程如图所示:
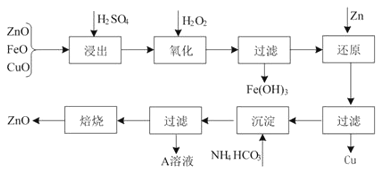
(1)上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),则该H2SO4的物质的量浓度为______________ (保留两位小数) 。
(2)上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04 mol·L-1,控制滤液的pH,加入H2O2后产生大量红褐色沉淀。
①粗略测定溶液pH的实验操作是___________________________________________。
②已知:常温下Fe(OH)3的Ksp=4.0×10-38。滤液的pH至少为________时,溶液中Fe3+开始沉淀。
(3)A溶液中主要含有的溶质是______________,验证溶质所含阳离子的方法是_____________。
(4)制备ZnO所焙烧的物质是含结晶水的碱式碳酸锌。取碱式碳酸锌6.82g,溶于HCl生成CO2 448 mL(标准状况下),溶解过程消耗HCl 0.12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示(a、b为铜电极)。下列说法中不正确的是( )
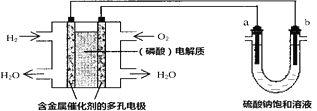
A. 电池工作时,正极反应式为:O2+4H++4e-=2H2O
B. 电解时,当阴极逸出a mol气体,同时有W克Na2SO410H2O 析出,保持温度不变,剩余溶中的硫酸钠的质量分数是![]()
C. 电解时,电子流动路径是:负极→外电路→阴极→阳极→正极
D. 若忽略能量损耗,当电池中消耗0.01mol O2 时,b 极周围会产生0.02mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将Ⅰ阀关闭,Ⅱ阀打开,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③NaOH溶液 ④饱和碳酸钠溶液 ⑤水
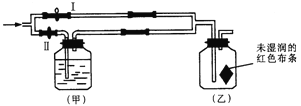
A. ①③ B. ②⑤ C. ②③⑤ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,不能表明反应: 2NO2(g)![]() 2NO(g)+O2(g) 已达平衡状态的是
2NO(g)+O2(g) 已达平衡状态的是
A. 容器中颜色不再改变 B. 混合气平均相对分子质量不再改变
C. 混合气密度不再改变 D. 单位时间内生成n mol O2的同时生成2n mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法错误的是( )
A.常温常压下,1mol甲烷分子中所含质子数为10NA
B.2mol/L的NaCl溶液中钠离数目为2NA
C.常温下,46gNO2和N2O4的混合气体中含有的氮原子数目为NA
D.若120g石墨能写a个字,则平均每个字的含有10NA/a个碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com