

分析 为探究带有结晶水的复盐晶体X(共含五种元素)的组成和性质,X和足量氢氧化钠固体反应生成气体A中含氨气,通过碱石灰干燥得到气体F为氨气,物质的量=$\frac{8.96L}{22.4L/mol}$=0.4mol,说明X中含0.4mol铵根,反应后的固体加水溶解得到无色溶液B和黑色固体C,无色溶液B中加入足量氯化钡和稀盐酸生成白色沉淀D为BaSO4,其物质的量=$\frac{116.5g}{233g/mol}$=0.5mol,黑色固体C和乙醇蒸气反应生成红色固体E为铜,物质的量=$\frac{19.2g}{64g/mol}$=0.3mol,则X中含铵根、硫酸根、铜离子,据此分析判断.
解答 解:为探究带有结晶水的复盐晶体X(共含五种元素)的组成和性质,X和足量氢氧化钠固体反应生成气体A中含氨气,通过碱石灰干燥得到气体F为氨气,物质的量=$\frac{8.96L}{22.4L/mol}$=0.4mol,说明X中含0.4mol铵根,反应后的固体加水溶解得到无色溶液B和黑色固体C,无色溶液B中加入足量氯化钡和稀盐酸生成白色沉淀D为BaSO4,其物质的量=$\frac{116.5g}{233g/mol}$=0.5mol,黑色固体C和乙醇蒸气反应生成红色固体E为铜,物质的量=$\frac{19.2g}{64g/mol}$=0.3mol,则X中含铵根、硫酸根、铜离子,X含有的元素有S、O、H、Cu、N,结合足量计算所含结晶水,
83.4g晶体中含结晶水质量=83.4g-0.3mol×64g/mol-0.4mol×18g/mol-0.5mol×96g/mol=9g,水物质的量=$\frac{9g}{18g/mol}$=0.5mol,X的化学式结合微粒物质的量之比得到n(Cu):n(NH4+):n(SO42-):n(H2O)=0.3mol:0.4mol:0.5mol:0.5mol=3:4:5:5,化学式为Cu3(NH4)4(SO4)5•5H2O,C→E化学方程式为:CuO+C2H5OH$\stackrel{△}{→}$Cu+CH3CHO+H2O,
故答案为:Cu;N;Cu3(NH4)4(SO4)5•5H2O;CuO+C2H5OH$\stackrel{△}{→}$Cu+CH3CHO+H2O.
点评 本题考查了物质组成和的实验探究、元素守恒和反应现象是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 使紫色石蕊试液变红 | B. | 易溶于水 | ||
| C. | 发生酯化反应 | D. | 无色无味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四氧化三锰(Mn3O4)在电子工业有广泛应用.
四氧化三锰(Mn3O4)在电子工业有广泛应用.| 序号 | 反应 | △H(kJ•mol-1) | K | |
| 300°C | 800°C | |||
| Ⅰ | MnCO3(s)+$\frac{1}{2}$O2(g)?MnO2(s)+CO2(g) | a | 3.0×107 | 1.8×105 |
| Ⅱ | MnCO3(s)+$\frac{1}{4}$O2(g)?$\frac{1}{2}$Mn2O3(s)+CO2(g) | b | 1.7×103 | 2.4×105 |
| Ⅲ | MnCO3(s)+$\frac{1}{6}$O2(g)?$\frac{1}{3}$Mn3O4(s)+CO2(g) | c | 9.8 | 9.6×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
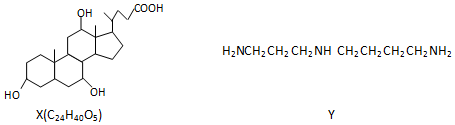
| A. | 1molX在浓硫酸作用下发生消去反应,最多生成3molH2O | |
| B. | 1molY发生类似酯化的反应,最多消耗2molX | |
| C. | X与足量HBr反应,所得有机物的分子式为C24H37O2Br3 | |
| D. | Y与癸烷的分子链均呈锯齿形,但Y的极性较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com