
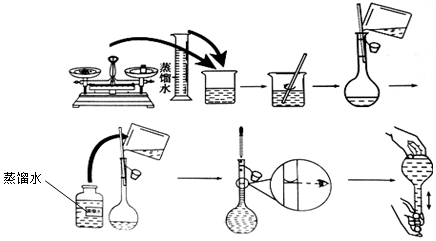
分析 (1)依据配制溶液应选用大于等于该体积的容量瓶判断;
(2)依据m=cVM计算需要Na2CO3的质量;
(3)依据定容时的正确操作方法解答;
(4)依据容量瓶只能作配置容器,不能作存放容器判断;
(5)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)配制溶液应选用大于等于该体积的容量瓶,所以配制该溶液应选用1000mL容量瓶;
故答案为:1000;
(2)欲用Na2CO3固体配制950mL 0.1mol•L-1的Na2CO3溶液,需选择1000ml容量瓶,
需要Na2CO3的质量m=0.1mol/L×1L×106g/mol=10.6g;
故答案为:10.6;
(3)定容时向容量瓶中加入蒸馏水,直到液面在刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至液面的最低点与刻度线相切,盖好瓶塞,摇匀;
故答案为:胶头滴管;
(4)容量瓶只能作配置容器,不能作存放容器,所以配制好的溶液不能长期存放在容量瓶中,故答案为:不能;
(5)A.在烧杯中搅拌溶解溶质时,溅出少量溶液,导致溶质的物质的量偏小,溶液的浓度偏低,故选;
B.未将洗涤烧杯内壁的溶液转移至容量瓶,导致溶质的物质的量偏小,溶液的浓度偏低,故选;
C.定容时,加水超过了刻度线,倒出一些再重新加水至刻度线,导致溶质的物质的量偏小,溶液的浓度偏低,故选;
D.将所配溶液从容量瓶转移到试剂瓶时有少量溶液溅出,对溶液浓度不会产生影响,溶液浓度不变,故不选;
故选:ABC.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,题目难度不大,熟悉配置原理是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 铜的化学性质不活泼,但在潮湿的空气中生锈 | |
| C. | 玻璃钢是复合材料,其中合成树脂做增强体,玻璃纤维做基体 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式为 N:::N | B. | CH4分子的球棍模型: | ||
| C. | HClO的结构式为H-O-Cl | D. | 氟离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.3 g Na变成Na2O2时,失去0.2NA个电子 | |
| B. | 常温常压下,32 g氧气和32 g臭氧都含有2NA个氧原子 | |
| C. | 含0.2 mol NaOH的溶液中含有NA个Na+离子 | |
| D. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com