
分析 (1)①Ⅰ. H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
Ⅱ. CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
根据盖斯定律,Ⅰ×3-Ⅱ可得:CO2(g)+3H2(g)═CH3OH(g)+H2O(g),反应焓变也进行相应计算;
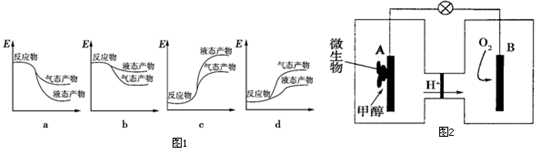
②根据①中分析可知,正反应为放热反应,则反应物总能量大于生成物总能量,由于气态物质的能量高于液态物质,故生成液态产物放出的热量更多;
(2)①甲醇在负极失电子发生氧化反应,A为负极,氧气在正极得到电子发生还原反应,B为正极,电子从负极经外电路流向正极;
②B电极反应是氧气得到电子生成氢氧根离子在酸性溶液中生成水,氢离子通过交换膜移向正极,氢离子物质的量不变,溶液体积变化忽略不计,溶液中氢离子浓度不变;
③A电极是原电池负极,甲醇失电子发生氧化反应,在酸溶液中生成二氧化碳,由电荷守恒可知有H+生成.
解答 解:(1)①Ⅰ. H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
Ⅱ. CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
根据盖斯定律,Ⅰ×3-Ⅱ可得:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;
②根据①中分析可知,正反应为放热反应,则反应物总能量大于生成物总能量,由于气态物质的能量高于液态物质,故生成液态产物放出的热量更多,图象中a符合,
故答案为:a;
(2)①甲醇在负极失电子发生氧化反应,A为负极,氧气在正极得到电子发生还原反应,B为正极,电子从负极经外电路流向正极.即电子由A极经外电路流向B极,
故答案为:从A到B;
②B电极反应是氧气得到电子生成氢氧根离子在酸性溶液中生成水,氢离子通过交换膜移向正极,氢离子物质的量不变,溶液体积变化忽略不计,溶液中氢离子浓度不变,故溶液pH不变,
故答案为:不变;
③A电极是原电池负极,甲醇失电子发生氧化反应,在酸溶液中生成二氧化碳,由电荷守恒可知有H+生成,电极反应式为:CH3OH+H2O-6e-═6H++CO2↑,
故答案为:CH3OH+H2O-6e-═6H++CO2↑.
点评 本题考查热化学方程式的书写、原电池等,侧重考查学生对知识的综合应用,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用酸性高锰酸钾溶液除去乙烷中的乙烯 | |
| B. | 用苯与浓溴水在FeBr3催化作用下制溴苯 | |
| C. | 用食醋浸泡有水垢的水壶清除其中的水垢 | |
| D. | 用乙醇从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0 kJ | |
| B. | H2SO4和NaOH反应的中和热△H=-57.3 kJ•mol-1,则1molH2SO4和1molBa(OH)2反应的反应热△H=-114.6kJ•mol-1 | |
| C. | 石墨转化为金刚石是吸热反应,可知金刚石的燃烧热更大 | |
| D. | 在恒温时,压缩容器的体积,则2SO2+O2?2SO3平衡正向移动,该反应的△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NH3•H2O溶液鉴别Al3+、Mg2+和Ag+ | |
| B. | 用水鉴别乙醇、甲苯和溴苯 | |
| C. | 用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- | |
| D. | 用澄清石灰水鉴别CO、CO2、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 元素周期表第ⅠA族元素都是金属元素 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、H+、HCO3-、Cl- | B. | Fe3+、K+、CO32-、NO3- | ||
| C. | K+、Al3+、Cl-、OH- | D. | K+、Ba2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向FeCl3溶液中滴加NaOH溶液 | 制备Fe(OH)3胶体 |
| B | 将CO2通入水玻璃溶液中 | 证明C元素的非金属性大于Si |
| C | 向苯和苯酚的混合溶液中加入足量的浓溴水,充分反应后过滤 | 除去苯中混有的苯酚 |
| D | 淀粉与稀H2SO4共热,再加入银氨溶液水浴加热 | 验证淀粉水解产物有无还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | 平衡向逆反应方向移动 | ||
| C. | 平衡不发生移动 | D. | 相对原平衡n(A)、n(B)减少,n(C)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com