
分析 (1)硫酸铝溶液与过量氨水反应生成氢氧化铝和硫酸铵,氢氧化铝为两性氢氧化物,可与氢氧化钠溶液或盐酸溶液反应;
(2)首先发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,然后发生反应:NH4Cl+NaOH=NH3.H2O+NaCl,最后发生反应:Al(OH)3+NaOH=NaAlO2+H2O.
解答 解:(1)硫酸铝溶液与过量氨水反应生成氢氧化铝和硫酸铵,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,氢氧化铝为两性氢氧化物,加入足量NaOH溶液,沉淀逐渐溶解,生成偏铝酸钠,另一份加入足量稀盐酸,生成氯化铝和水,方程式为Al(OH)3+3HCl=AlCl3+3H2O,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;沉淀逐渐溶解;Al(OH)3+3HCl=AlCl3+3H2O;两性氢氧化物;
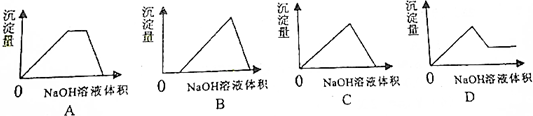
(2)等物质的量NH4Cl和AlCl3混合溶液中逐滴加入NaOH溶液至过量,首先发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,然后发生反应:NH4Cl+NaOH=NH3.H2O+NaCl,最后发生反应:Al(OH)3+NaOH=NaAlO2+H2O,图象A符合.
故答案为:A.
点评 本题考查铝元素单质及化合物的性质与用途、根据方程式的计算等,难度不大,注意将铝离子转化为氢氧化铝应选择弱碱.


科目:高中化学 来源: 题型:解答题
 能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.
能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂组合/NH3体积(mL) | 6.0gCa(OH)2(s,过量) | 6.0NaOH(s,过量) | 6.0g CaO(s,过量) |
| 5.4g NH4Cl(s) | ①/1344 | ②/1568 | ③/1792 |
| 5.4(NH4)2SO4(s) | ④1364 | ⑤1559 | ⑥/1753 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 一定含有Ag+和SO42- | D. | 可能含有Ag+或SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②⑥ | C. | ④⑤ | D. | ④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成SO3为2 mol | |
| B. | 反应放出197 kJ 的热量 | |
| C. | SO2和SO3物质的量之和一定为2mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使溴水褪色,也能使高锰酸钾酸性溶液褪色 | |
| B. | 在一定条件下与H2充分反应,生成1-丙醇 | |
| C. | 能发生银镜反应表现出氧化性 | |
| D. | 在一定条件下能被空气氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com