
(15分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源

(1)填充物用60 ℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。
铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
科目:高中化学 来源:2014-2015湖北省高一3月月考化学试卷(解析版) 题型:选择题
向含有Fe2+、Al3+、NH4+、Na+、K+的溶液中加入过量的Na2O2固体,微热溶液使其充分反应,再通入过量的HCl气体,则反应后溶液中离子浓度大量减小的是
A.Na+和K+ B.Al3+和Na+
C.Fe2+和NH4+ D.Fe2+和K+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省梅州市高三高三总复习质检理综化学试卷(解析版) 题型:选择题
对于常温下PH=10的氨水,下列说法正确的是
A.该溶液与PH=10的 Ba(OH)2溶液,溶质的物质的量浓度之比为2:1
B.该溶液由水电离出来的c(H+)与PH=4的NH4Cl溶液相同
C.降低温度,溶液的c(NH4+)/ c(NH3·H3O)减小,PH降低
D.往该溶液中加入足量的NH4Cl固体后,c(NH4+) + c(NH3·H3O)= c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.钠和硫酸铜溶液反应:2Na+Cu2+=2Na++Cu
B.AlCl3溶液中加入足量的氨水制Al(OH)3:Al3++3OH—=Al(OH)3↓
C.向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3—+OH—=CaCO3↓+H2O
D.二氧化硅溶于NaOH溶液:SiO2+2OH—=SiO32—+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
下列化学用语的表示正确的是
A.CS2的比例模型:
B.乙醇的结构简式:C2H6O
C.核内有8个中子的碳原子: 86C
D.HClO的结构简式:H—Cl—O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:选择题
酚酞,别名非诺夫他林,是制药工业原料,其结构如图所示,有关酚酞说法不正确的是

A.分子式为C20H14O4
B.可以发生取代反应、加成反应、氧化反应
C.含有的官能团有羟基、酯基
D.1 mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10 mol和4 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第二次质量预测理综化学试卷(解析版) 题型:填空题
[化学——选修2:化学与技术](15分)利用生产磷铵[(NH4)3P04]排放的废渣磷灰石[(Ca3(P04)2)]制取硫酸并联产水泥的工艺流程如下:
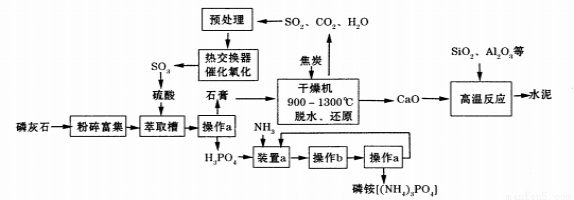
(1)操作a的名称 ,实验室中进行此操作时用到的玻璃仪器有 。
(2)在实验室中操作b包括____、冷却结晶。
(3)干燥机中发生反应的化学方程式为 。
(4)水泥常用做建筑材料,是利用了水泥的 性质。
(5)SO2的催化氧化反应为2SO2(g)十02(g)  2S03(g)。实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
2S03(g)。实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
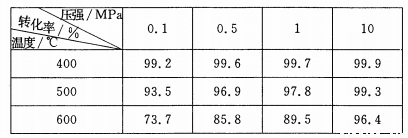
①实际生产中,S02的催化氧化反应是在常压、400 ℃ —500 ℃ 条件下进行。采用常压的主要原因是 ;该反应化学平衡常数大小关系是:K(400 ℃ ) K(500 ℃)(填“>”、“<”或“=” )。
②催化氧化时使用热交换器的原因是 。
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾。下列能用于测定硫酸尾气中SO2含量的试剂组是 。(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2C03溶液、酚酞试液
c、碘水、淀粉溶液 d、KMn04溶液、稀硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.油脂的氢化是指将不饱和程度较高、熔点较低的液态油,通过催化加氢,可提高饱和度,转化成半固态的脂肪的过程
B.在酸性条件下,蔗糖水解成葡萄糖和果糖,它们都能被溴水氧化
C.氨基酸是两性化合物,只有两个不同氨基酸分子间脱水才能形成肽键
D.蛋白质遇到醋酸铅变性沉淀,加入大量的水,沉淀还可溶解
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省洛阳市高三第二次统一考试理综化学试卷(解析版) 题型:填空题
(15分)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气作为能源最大的优点是燃烧产物是水,无污染。请你再列举一条氢气作为能源的优点:_____________________________________________。
(2)LiAlH4是一种重要的储氢载体,能与水反应得到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为_______________________________________。
(3)氮化锂(Li3N)是非常有前途的储氢材料,其在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为;Li3N+2H2 LiNH2+2LiH,氧化产物为___________(填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________%(精确到0.1)。
LiNH2+2LiH,氧化产物为___________(填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________%(精确到0.1)。
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:

在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=__________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。

①导线中电子移动方向为__________。(用A、D表示)
②生成目标产物的电极反应式为_______________________________。
③该储氢装置的电流效率η=_________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com