
| A. | 电解稀硫酸,实质是电解水,溶液pH不变 | |
| B. | 电解氢氧化钠稀溶液,溶液浓度增大,pH变小 | |
| C. | 电解氯化钠溶液,溶液浓度减小,pH不变 | |
| D. | 电解硫酸铜溶液,要消耗OH-溶液,pH变小 |
分析 A.惰性电极电解硫酸溶液,实质电解水;
B.惰性电极电解NaOH溶液,实质电解水;
C.惰性电极电解NaCl溶液,反应生成NaOH;
D.惰性电极电解硫酸铜溶液,氢氧根离子放电生成硫酸;
解答 解:A.惰性电极电解硫酸溶液,实质电解水,硫酸浓度变大,pH减小,故A错误;
B.惰性电极电解NaOH溶液,实质电解水,碱的浓度增大,pH增大,故B错误;
C.惰性电极电解NaCl溶液,溶液中氢离子、氯离子放电,反应生成NaOH,所以溶液浓度减小,pH增大,故C错误;
D.惰性电极电解硫酸铜溶液,氢氧根离子放电生成硫酸,消耗OH--溶液pH变小,故D正确;
故选D.
点评 本题考查电解原理,注意惰性电极条件下溶液中离子的放电顺序来判断电解的物质是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
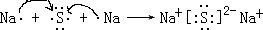 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 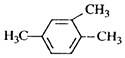 1,3,4-三甲苯 1,3,4-三甲苯 | B. | CH3CH(Cl)CH3 2-氯丙烷 | ||
| C. | 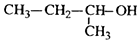 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 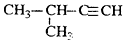 2-甲基-3-丁炔 2-甲基-3-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.8 g N2和CO的混合气体所含原子数为0.2 NA | |
| B. | 1 mol Cl2与足量Fe完全反应,转移3NA个电子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3溶液中含有0.1 NA个HCO3- | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(H+)=10-13mol•L溶液:Na+、NH4+、CO32-、SO42- | |
| B. | 澄清透明溶液:Mg2+、Cu2+、SO42-、Cl- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014溶液:Ba2+、Na+、ClO-、NO- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:
如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
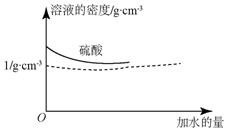 已知硫酸的密度与所加水量的关系如图所示,
已知硫酸的密度与所加水量的关系如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:推断题
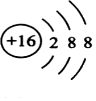 .
.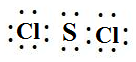 ,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.
,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.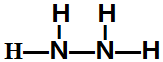 .常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.
.常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com