
下列进行性质比较的实验,不合理的是( )
A.比较Cu、Fe的还原性:铜加入硫酸铁溶液中
B.比较镁、铝的金属性:取一小段去氧化膜的镁带和铝片,分别加入1.0 mol·L-1的盐酸中
C.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸
D.比较氯、溴的非金属性:溴化钠溶液中通入氯气
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:2015-2016学年四川省高二上第二次段考化学试卷(解析版) 题型:填空题
现有八种有机物:A 乙醇 B 甲苯 C 苯酚 D 甲酸 E 溴乙烷
F 乙醛 G 乙烯 H 乙酸乙酯
(1)能跟银氨溶液发生银镜反应的是_______________(填序号,下同)
(2)能使氯化铁溶液变紫色的是_______________
(3)能够与活泼金属反应生成氢气的是________________
(4)常温下能跟溴水反应生成白色沉淀的是_____________
(5)在一定条件下能跟氢氧化钠水溶液反应的是_______________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上第三次段考化学试卷(解析版) 题型:填空题
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g) p C(g)+q D(g)。
p C(g)+q D(g)。
(1)若开始时加入A物质m mol,B物质n mol,则达到平衡时 A、B的转化率____________.(填“相等”或“不等”)
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间T的关系如图3所示。则T1(填“>”、“<”或“=”) T2,该反应的正反应的△H(填“>”、“<”或“=”) 0。

(3)一定条件下,从正反应开始达到化学平衡过程中,混合气体的平均相对分子质量随时间的变化如图4所示,测得达到平衡时A、B、C、D的物质的量均为1 mol。

①若在恒温恒容的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”)______ 。
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”) 。
(4)若该反应的逆反应速率与时间的关系如下图所示:

可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了条件,试判断t2时改变的条件是 。
查看答案和解析>>
科目:高中化学 来源:2016届广西河池市高三上第五次月考理综化学试卷(解析版) 题型:实验题
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如右(加热和夹持装置等略):
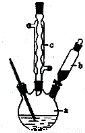
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是 。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器c的作用是 ;仪器b的名称是 ,其作用是 。反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。
A 分液漏斗 B 漏斗 C 烧杯 D 直形冷凝管 E 玻璃棒
(3)提纯粗苯乙酸的方法是 ,最终得到44g纯品,则苯乙酸的产率是 。
(4)用CuCl2•2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
(6)在实际操作时,发现b中液体不容易滴下来,你认为应将b改为 (填仪器名称)即可解决此问题。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
有下列两种转化途径,某些反应条件和产物已省略,下列有关说法不正确的是
途径①: 途径②:
途径②:
A.途径①反应中体现了浓硝酸的强氧化性和酸性
B.途径②的第二步反应在实际生产中可以通过增大O2浓度来提高产率
C.由途径①和②分别制取1mol H2SO4,理论上各消耗1mol S,各转移6mol电子
D.途径②与途径①相比更能体现“绿色化学”理念,是因为途径②比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省普宁市高一上学期第三次月考化学试卷(解析版) 题型:选择题
工业上常用FeCl3溶液与铜反应制作印刷电路板。该反应的化学方程式为:2FeCl3+Cu =2FeCl2+CuCl2。取上述反应后溶液10 mL进行分析,测得其中c(Fe3+)为1mol·L—1。向其中加入足量的硝酸银溶液,过滤、干燥,可得到沉淀l7.22g。则上述反应后的10mL溶液中c(Cu2+)为
A.0.5mol·L—1 B.1.5 mol·L—1 C.0.4 mol·L—1 D.0.25 mol·L—1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列事实能说明H2SO3不是强电解质的是
① 0.05 mol/L H2SO3 溶液的pH>1 , ② 常温下Na2SO3溶液的pH>7 ,
③ H2SO3不稳定,易分解, ④ H2SO3能与碳酸钠反应制CO2 ,
⑤ H2SO3能和水以任意比例互溶, ⑥ 1mol H2SO3能够消耗2 mol NaOH
A.①②⑤ B.①②④ C.①②③⑤ D.①②
查看答案和解析>>
科目:高中化学 来源:2016届浙江省深化课程改革协作校高三上学期11月期中联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.c(H+)= c(OH-)的溶液一定呈中性
B.常温下,将pH=11的氨水稀释后,溶液中所有离子的浓度均降低
C.常温下,pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液pH>7
D.0.1 mol•L-1 Na2S溶液中:2c(Na+) = c(S2-) + c(HS-) + c(H2S)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上学期第二次月考化学试卷(解析版) 题型:选择题
同温同压下,下列气体的密度最大的是
A.H2 B.Cl2 C.HCl D.CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com