


科目:高中化学 来源: 题型:
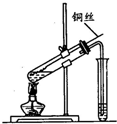 如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )
如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )| A、该实验说明浓硫酸具有强氧化性 |
| B、反应后试管中观察到的白色固体CuSO4 |
| C、该实验产生的气体不会造成环境污染,因此不需尾气处理 |
| D、实验结束,将铜丝拉离液面终止反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
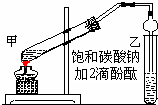 实验室制取乙酸乙酯的主要步骤如图:
实验室制取乙酸乙酯的主要步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下将CaO、Na2O、Na、NaOH各5克分别投入100克水中,充分搅拌后,所得溶液中溶质的质量分数最小的是CaO |
| B、正戊烷、异戊烷、新戊烷的熔沸点由高到低的顺序为新>异>正 |
| C、AlO2-、HCO3-、Na+、K+等离子不能在水溶液里大量共存 |
| D、将NaHCO3溶液和Na2SO3溶液分别蒸干灼烧,得到的固体都不是原溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能层序数越大,S的轨道的半径越大 |
| B、电子的运动和行星相似,围绕的原子核在固定的轨道上高速旋转 |
| C、能量低的电子只能在S轨道上运动,能量高的电子总在f轨道上运动 |
| D、同一元素的原子中,在同一能级上运动的电子,其运动状态相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com