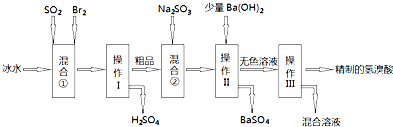
欧盟定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO
2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
C+
KMnO
4+
H
2SO
4→
CO
2↑+
MnSO
4+
K
2SO
4+
H
2O
(2)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式:
.
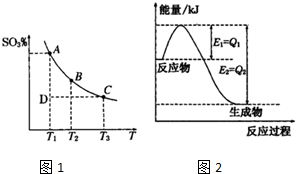
(3)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T
1和T
2时,测得各物质平衡时物质的量如表:
 | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式
.
②上述反应T
1℃时的平衡常数为K
1,T
2℃时的平衡常数为K
2.
Ⅰ.计算K
1=
.
Ⅱ.根据上述信息判断,温度T
1和T
2的关系是
(填序号).
a.T
1>
T2 b.T
1<T
2 c.无法比较
(4)CO
2经常用氢氧化钠溶液来吸收,现有0.4molCO
2,若用200mL 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
.
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li
2CO
3 和 Na
2CO
3 的熔融盐混合物作电解质,CO 为负极燃气,空气与 CO
2 的混合气为正极助燃气,制得在 650℃下工作的燃料电池,其负极反应式:2CO-4e
-+2CO
32-=4CO
2,则正极反应式:
.
(6)CO
2在自然界循环时可与CaCO
3反应,CaCO
3是一种难溶物质,其Ksp=3.8×10
-9.CaCl
2溶液与Na
2CO
3溶液混合可形成CaCO
3沉淀,现将等体积的CaCl
2溶液与Na
2CO
3溶液混合,若Na
2CO
3溶液的浓度为2×10
-4mo1/L,则生成沉淀所需CaCl
2溶液的最小浓度为
.