
【题目】氮气用来填充灯泡是由于氮气
A.无色B.无味C.性质稳定D.密度小
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol.下列说法或表达正确的是( )
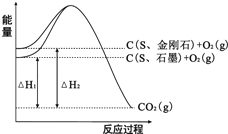
A.金刚石比石墨稳定
B.C(s、石墨)=C(s、金刚石) △H=+1.5kJ/mol
C.△H1<△H2
D.如果使用催化剂,△H1和△H2都变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍.
(1)求该有机物的分子式 .
(2)该有机物链状同分异构体的结构简式为(有几种就写几种,不一定填满):、、、
(3)若有机物A在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2K2CrO4+H2SO4![]() K2Cr2O7+K2SO4+H2O
K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4![]() 3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
③Fe2(SO4)3+2HI![]() 2FeSO4+I2+H2SO4
2FeSO4+I2+H2SO4
下列结论正确的是
A.①②③均是氧化还原反应
B.氧化性强弱顺序是K2Cr2O7>Fe2(SO4)3>I2
C.反应②中氧化剂与还原剂的物质的量之比为6∶1
D.反应③中0.1 mol还原剂共失去电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“地沟油”可与醇加工制成生物柴油变废为宝。关于“地沟油”的说法正确的是
A.属于烃类B.由不同酯组成的混合物
C.密度比水大D.不能发生皂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼冰铜(mCu2OnFeS)可得到粗铜,冰铜与酸反应可以生成硫化氢(见图1).完成下列填空: 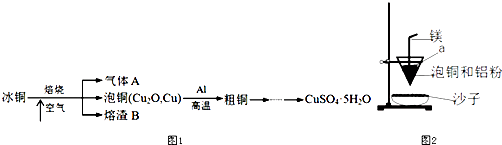
(1)气体A中的大气污染物可选用下列试剂中的(填序号)吸收.
a.浓H2SO4 b.浓HNO3 c.NaOH溶液 d.氨水
(2)实验室可用如图2的装置完成泡铜冶炼粗铜的反应.
①泡铜冶炼粗铜的化学方程式是;
②装置中镁带的作用是;
③泡铜和铝粉混合物表面覆盖少量白色固体a,a是;
(3)将H2S和O2在密闭容器中点燃,充分反应后恢复到原来的温度和压强(120℃、101kPa),气体体积减少30%,求原混合其气体中H2S的体积分数 . (不考虑H2S的自身分解)已知:氧气不足时:2H2S+O2 ![]() 2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
(4)已知:SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ/mol
SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ/mol
则由SiCl4制备硅的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在S2、Fe2+、Fe3+、Mg2+、S、I、H+中,只有氧化性的是____________,只有还原性的是____________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O ②NH3+NO→HNO2+H2O ③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是____________。
(3)下列三个氧化还原反应中,氧化性最强的物质是______________。
①2FeCl3+2KI![]() 2FeCl2+2KCl+I2
2FeCl2+2KCl+I2
②2FeCl2+Cl2![]() 2FeCl3
2FeCl3
③2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl与I共存,为了氧化I而Cl不被氧化,除单质外,还应用上述反应中的__________作氧化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.化工工业中常用乙苯脱氢的方法制备苯乙烯.
已知某温度下:
反应①:CO2(g)+H2(g)→CO(g)+H2O(g),△H=+41.2kJ/mol;
反应②: ![]() (g)→
(g)→ ![]() (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol;
①②的化学反应平衡常数分别为K1、K2 ,
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式
该反应的化学平衡常数K=(用K1、K2表示)
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在图中画出t1之后的正逆反应曲线,并作出标注. 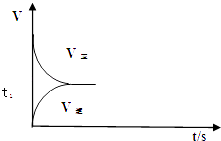
(3)Ⅱ.一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g).图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响. 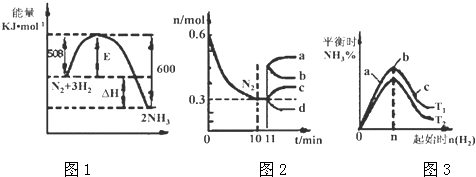
升高温度,该反应的平衡常数(填“增大”或“减小”或“不变”).
(4)由图2信息,计算10min内该反应的平均速率v(H2)= , 从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为(填“a”或“b”或“c”或“d”)
(5)图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是点,温度T1T2(填“>”或“=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质或微粒性质的比较中正确的是
A.碳碳键键长:乙烯>苯
B.密度:一氯乙烷>一氯丁烷
C.热稳定性:NaHCO3>Na2CO3>H2CO3
D.沸点:H2O>H2S>H2Se
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com