
拆开1mol化学键所吸收的能量是该化学键的键能,它的大小可以衡量化学键的强弱.
| 化学键 | Si﹣O | Si﹣Cl | H﹣H | H﹣Cl | Si﹣Si | Si﹣C |
| 键能/kJ•mol﹣1 | 460 | 360 | 436 | 431 | 176 | 347 |
下列说法中错误的是( )
|
| A. | SiCl4的熔点比SiC低 |
|
| B. | 拆开1 mol晶体硅中的化学键所吸收的能量为176kJ |
|
| C. | HCl的熔点比H2高 |
|
| D. | 拆开1 mol晶体SiC中的化学键所吸收的能量为1388kJ |
考点:
键能、键长、键角及其应用.
专题:
化学键与晶体结构.
分析:
A.SiCl4的是分子晶体,SiC是原子晶体,熔点原子晶体>分子晶体;
B.晶体硅中1个Si原子与周围的4个Si形成正四面体空间网状结构,每个Si原子形成4个Si﹣Si键,每个Si﹣Si键为1个
Si原子通过 Si﹣Si键,所以1mol晶体硅中含有Si﹣Si键为1mol×4×
Si﹣Si键,所以1mol晶体硅中含有Si﹣Si键为1mol×4× =2mol;
=2mol;
C.范德华力越大熔沸点越高;
D.晶体SiC中1个Si原子与周围的4个C形成正四面体空间网状结构,每个Si原子形成4个Si﹣C键,每个Si﹣C键为1个Si原子通过 Si﹣C键,所以1mol晶体硅中含有Si﹣C键为1mol×4×
Si﹣C键,所以1mol晶体硅中含有Si﹣C键为1mol×4× =2mol.
=2mol.
解答:
解:A.SiCl4的是分子晶体,SiC是原子晶体,熔点原子晶体>分子晶体,所以SiCl4的熔点比SiC熔点低,故A正确;
B.晶体硅中1个Si原子与周围的4个Si形成正四面体空间网状结构,每个Si原子形成4个Si﹣Si键,每个Si﹣Si键为1个
Si原子通过 Si﹣Si键,所以1mol晶体硅中含有Si﹣Si键为1mol×4×
Si﹣Si键,所以1mol晶体硅中含有Si﹣Si键为1mol×4× =2mol,拆开1mol晶体硅中的化学键所吸收的能量为176kJ/mol×2mol=352kJ,故B错误;
=2mol,拆开1mol晶体硅中的化学键所吸收的能量为176kJ/mol×2mol=352kJ,故B错误;
C.相对分子质量越大,范德华力越大,熔沸点越高,故C正确;
D.晶体硅中1个Si原子与周围的4个C形成正四面体空间网状结构,每个Si原子形成4个Si﹣C键,每个Si﹣C键为1个Si原子通过 Si﹣C键,所以1mol晶体硅中含有Si﹣C键为1mol×4×
Si﹣C键,所以1mol晶体硅中含有Si﹣C键为1mol×4× =2mol,拆开1mol晶体硅中的化学键所吸收的能量为347kJ/mol×2mol=694kJ,故D正确.
=2mol,拆开1mol晶体硅中的化学键所吸收的能量为347kJ/mol×2mol=694kJ,故D正确.
故选B.
点评:
本题考查晶体类型与性质、键能概念及键能键长的运用等,难度中等,BD选项为易错点,要根据晶体结构判断1mol晶体硅中含有Si﹣Si键为2mol.


科目:高中化学 来源: 题型:
下列实验下列实验目的能实现的是 ( )
A.用10 mL 量筒量取5.2 mL盐酸 B.向小试管中加入100mL稀盐酸
C.用托盘天平称取25.12gNaCl固体 D.用100 mL容量瓶配制50mL0.1 mol/L的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列做法会对人体健康造成较大危害的是( )
A.用大量SO2漂白银耳
B.用小苏打(NaHCO3)焙制糕点
C.用食醋清洗热水瓶胆内壁附着 的水垢(CaCO3)
的水垢(CaCO3)
D.用消毒液(有效成分NaClO)对餐具进行杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
下图虚线框中的装置可用来检验浓硫酸与木炭粉在
加热条件下反应产生的所有气体产物,填写下列空白:

(1)写出木炭粉与浓硫酸反应的化学方程式 ;
(2)如果按装置中三部分仪器的连接顺序进行实验。
i. 装置①出现 现象说明有 生成;
ii. 装置②中前一瓶品红溶液褪色,说明有 生成;
iii. 能检验出最后一种产物的现象是 ;
(3)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是 ;不能确定的物质是 ;
(4)若将①、②、③装置拆除,替换装置④进行实验。
装置④中溶液颜色变浅绿色, 其反应的离子方程式是 ;
反应后往④中溶液加入氯化钡溶液,反应的离子方程式是 ;
(5)若④中的氯化铁溶液含有少量的亚铁离子,为检验少量亚铁离子的存在,可选用的试 剂是 。
剂是 。
A.KSCN溶液 B.稀盐酸 C.KMnO4 溶液 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属及金属键的说法正确的是( )
|
| A. | 金属键具有方向性和饱和性 |
|
| B. | 金属键是金属阳离子与自由电子间的相互作用 |
|
| C. | 金属导电是因为在外加电场作用下产生自由电子 |
|
| D. | 金属具有光泽是因为金属阳离子吸收并放出可见光 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子为非极性分子 |
| C | 金刚石的熔点低于石墨 | 石墨熔融时除了破坏共价键,还需破坏范德华力 |
| D | HF的沸点高于HCl | H﹣F的键能大于H﹣Cl |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列物质,用编号填空回答下列问题:
A.干冰 B.金刚石 C.氦 D.过氧化钠 E.二氧化硅 F.溴化铵
(1)通过非极性键形成的原子晶体是: .
(2)可由原子直接构成的晶体是: .
(3)含有离子键、共价键、配位键的化合物是: .
(4)含有非极性键的离子化合物是: .
(5)已知微粒间的作用力包括离子键、共价键、金属键、范德华力、氢键.氯化钠熔化,粒子间克服的作用力为 ;二氧化硅熔化,粒子间克服的作用力为 ;干冰气化,粒子间克服的作用力为 .A、B、C、D四种物质的熔点从低到高的顺序为 (填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
mA(s)+nB(g)⇌qC(g),的可逆反应,在1×105pa与2×105pa两种压力条件下,B的体积分数与温度的关系如右图所示,有关叙述正确的是( )
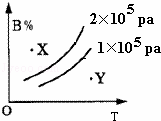
|
| A. | △H>0 | B. | X点,v正>v逆;Y点,v正<v逆 |
|
| C. | m+n>q | D. | X点比Y点反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于原子轨道的说法正确的是( )
|
| A. | 凡是中心原子采取sp3杂化方式成键的分子其几何构型都是正四面体 |
|
| B. | CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 |
|
| C. | sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相同的新轨道 |
|
| D. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化方式成键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com