
【题目】物质的量浓度相等的NaCl、FeCl2、FeCl3三种溶液分别与等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、FeCl2 、FeCl3三种溶液的体积之比是
A. 1:2:3 B. 3:2:1 C. 6::3:2 D. 1:1:1
【答案】C
【解析】
假设硝酸银的物质的量浓度为cmol/L,与三种盐发生反应方程式是:Ag++Cl-=AgCl↓,消耗的Cl-的物质的量相等,然后根据电解质中含有的Cl-的浓度与电解质的浓度的关系,利用n=cV计算。
假设AgNO3溶液的物质的量浓度为cmol/L,其体积是1L,则n(Ag+)=cmol/L×1L=cmol;根据Ag++Cl-=AgCl↓可知需消耗Cl-的物质的量也相等,n(Cl-)= cmol。假设NaCl、FeCl2、FeCl3溶液的浓度为xmol/L,溶液体积分别为V1,V2、V3,则xV1=2xV2=3xV3=c,则V1=![]() L,V2=
L,V2=![]() L,V3=
L,V3=![]() L,所以V1:V2:V3=
L,所以V1:V2:V3=![]() ,所以合理选项是C。
,所以合理选项是C。


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】CuSO4溶液是中学化学及农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是____________。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
①图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是_______(填“ZnSO4”或“CuSO4”)溶液;Cu极的电板反应式是_______。
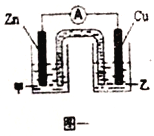
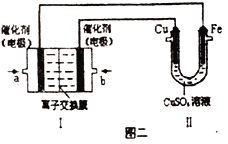
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则a处通入的是_______(填“CH4”或“O2”),a处电极上发生的电极反应式是_____________。若只把Ⅱ中电极均换为惰性电极,电解时的化学反应方程式为_____________________。若把Ⅱ中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体为672mL(标准状况下)时,溶液的pH=_______(假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;
(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式_________________________________
(2)步骤②“过滤1”后所得滤渣的主要成分为_____________
(3)步骤③“酸溶”,最适合选用的酸为___________,为提高酸溶速率,可采取的措施是____________________________________(任意写出一条)
(4)若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)=_________ mol·L-1
(5)从原子利用率的角度分析该流程的优点为____________________________________。
(6)步骤⑥“合成”三盐的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是
A. 标准状况下,分子数为NA的CO2、N2O混合气体体积约为22.4L,质量为44克
B. 常温常压下,16gO2所含的原子数为NA
C. 由O2和NO2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D. 标准状况下,22.4LH2O所合的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. Na2CO3+2HCl=2NaCl+H2O+CO2↑ B. 2 NaHCO3 ![]() Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑
C. Na2O+H2O=2NaOH D. Zn+H2SO4=ZnSO4 +H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有失去标签的甲、乙、丙、丁四瓶溶液,它们分別是Ba(NO3)2、H2SO4、Na2SO4、K2CO3的一种,为了鉴别他们,进行了如下实验:
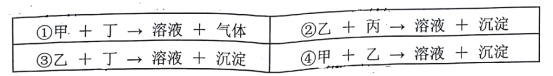
在④得到的沉淀中加入足量稀盐酸,沉淀迅速溶解,并产生无色无味的气体。
根据以上实验事实,回答下列问题:
(1)从④得到沉淀所使用的玻璃仪器有__________________________。
(2)乙、丁的名称分别是:乙_______________,丁_____________。
(3)请写出在④得到的沉淀中加入足量稀盐酸的离子反应方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,某研究性学习小组用下图装置进行“草酸晶体受热分解的部分产物的验证”的实验。请回答下列问题。

【资料查阅】
①草酸晶体在101 ℃时开始熔化,150 ℃时开始升华,175 ℃时开始分解;
②草酸钙和草酸氢钙均为白色不溶物。
(1)按照如图所示的装置,通过实验检验草酸晶体的部分分解产物,装置B中可观察到有气泡冒出且澄清石灰水变浑浊,由此甲同学判断草酸晶体分解的产物中有CO2。但立即遭到乙同学反对,其反对的理由可能是______________________________________。
(2)丙同学认为草酸晶体分解的产物中含有CO,为进行验证,X应选用________(填化学式)浓溶液,装置D的作用是____________________。
(3)实验过程中涉及如下操作:①点燃装置A处的酒精灯;②熄灭装置A处的酒精灯;③点燃装置E处的酒精灯;④熄灭装置E处的酒精灯。这4步操作由先到后的顺序为____________(填序号)。点燃E处酒精灯前必须要进行的操作是______________。
(4)实验过程中发现装置E中黑色粉末变红色,装置F中有黑色固体生成,经检测装置F中的固体为金属单质,则装置F中发生反应的化学方程式为________________________________________________________________________。
(5)丁同学用滴定法测定草酸晶体中结晶水的含量,进行了下列操作:
步骤一:用分析天平称取3.15 g纯净的该草酸晶体,配制成250 mL溶液。
步骤二:用移液管移取25.00 mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化。
步骤三:取0.100 mol·L-1标准酸性KMnO4溶液,进行滴定,三次结果如下表所示:
第一次 | 第二次 | 第三次 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知滴定反应的离子方程式为:MnO![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
①配制草酸溶液的操作步骤依次是:将晶体置于烧杯中,加水溶解,将溶液转移入________,洗涤,定容,摇匀。
②通过计算确定x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:

(1)取ag合金粉末放入蒸馏烧瓶,并加入足量浓硫酸,A、B中均无明显现象,原因是________________________________________________。
(2)反应一段时间后,B中的现象为___________________________。
(3)装置C的作用是________________;装置D的作用是___________,F的作用是___________________________________________。
(4)反应结束后,若U形管E增重m g,则合金中碳的质量分数为________。(用含m和a的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com