
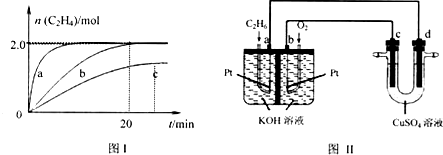
分析 (1)根据化学平衡状态特征判断分析,达到平衡时,一是等,二是定:
等是指v正=v逆,同一种物质:该物质的生成速率等于它的消耗速率;不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率;
定是指各成分含量保持不变:各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变;各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变;若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变;
(2)相对于曲线b,曲线a的斜率更大,但是最终C2H4的物质的量与曲线b相同,说明a的反应速率更大,只缩短了达平衡的时间,根据影响化学反应速率和化学平衡的条件进行分析;
(3)由图可知:c曲线的斜率更小,达平衡时,C2H4的物质的量减少;所以c曲线的反应速率更慢,其它条件不变,改变温度,速率减慢,则说明改变的条件是降温,再结合降温对平衡的影响进行分析;
(4)0~20min生成C2H4的物质的量为2mol,根据方程式可知生成C2H6的物质的量也是2mol,则C2H6的浓度变化量为$\frac{2mol}{2L}$=1mol•L-1,再根据v(C2H6)=$\frac{△C({C}_{2}{H}_{6})}{△t}$计算反应速率;
(5)燃料电池的负极充入燃料,发生氧化反应,则a为负极;正极充入氧气,发生还原反应,则b为正极;再考虑电解质溶液参加反应写出a电极反应式;c与b相连,与正极相连的是电解池的阳极,阳极发生氧化反应,则铜失去电子生成铜离子,由此写出c极电极反应式.
解答 解:(1)a.达平衡时各物质的量浓度是保持不变,不一定成比例,所以c(C2H6)与c(C2H4)的比值保持不变不一定在平衡,故a错误;
b.由反应C4H10(g)?C2H4(g)+C2H6(g)可知,恒容的容器中气体总物质的量随反应的进行而增大,容器中气体的压强逐渐增大,当容器中气体压强保持不变,说明气体总物质的量保持不变,则达到平衡状态,故b正确;
c.容器的体积一直不变,根据质量守恒,气体的总质量不变,所以气体的密度始终不变,故容器中气体密度保持不变不能说明达到平衡,故c错误;
d.单位时间内有1molC4H10消耗的方向是正方向,同时有1molC2H4生成也是正方向,方向相同,不能说明v正=v逆,不一定达平衡,故d错误;
故答案为:b;
(2)相对于曲线b,曲线a的斜率更大,但是最终C2H4的物质的量与曲线b相同,说明a的反应速率更大,只缩短了达平衡的时间,平衡没有移动,即没有改变化学平衡状态,所以改变的条件应是加入催化剂,
故答案为:加入催化剂;速率加快但平衡没有移动;
(3)由图可知:c曲线的斜率更小,达平衡时,C2H4的物质的量减少;所以c曲线的反应速率更慢,其它条件不变,改变温度,速率减慢,则改变的条件是降温,
由方程式C4H10(g)?C2H4(g)+C2H6(g)可知,降温的同时C2H4的物质的量在减少,说明平衡向逆方向移动,即逆方向是一个放热反应,正方向为吸热反应,
故答案为:吸热;
(4)0~20min生成C2H4的物质的量为2mol,根据方程式可知生成C2H6的物质的量也是2mol,则C2H6的浓度变化量为$\frac{2mol}{2L}$=1mol•L-1,
v(C2H6)=$\frac{△C({C}_{2}{H}_{6})}{△t}$=$\frac{1mol•{L}^{-1}}{20min}$=0.05mol•L-1•min-1,
故答案为:0.05mol•L-1•min-1;
(5)燃料电池的负极充入燃料C2H6,C2H6发生氧化反应,则a为负极;C2H6失去电子生成二氧化碳,二氧化碳与电解质溶液氢氧化钾反应生成碳酸钾,根据电荷守恒写出负极的电极反应式为:C2H6-14e-+18OH-=2CO32-+12H2O;正极充入氧气,发生还原反应,则b为正极;c与b相连,与正极相连的是电解池的阳极,阳极发生氧化反应,则铜失去电子生成铜离子,由此写出c极电极反应式:Cu-2e-=Cu2+,
故答案为:C2H6-14e-+18OH-=2CO32-+12H2O;Cu-2e-=Cu2+.
点评 本题考查化学平衡状态标志的判断,以及影响化学反应速率、化学平衡移动的条件,注意对图象题的理解,还考查化学反应速率的计算,比较简单,原电池与电解池的结合考查,难度适中.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 消耗B 0.08mol | B. | x=2 | ||
| C. | A的平衡浓度是1.4mol/L | D. | 平衡时气体压强是原来的0.94倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
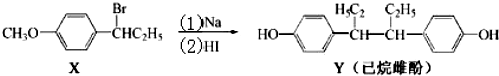
| A. | 化合物X 的分子式为C9H13BrO | B. | 化合物X苯环上的一溴代物有四种 | ||
| C. | 用FeCl3溶液可鉴别化合物X和Y | D. | 反应(2)属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol的白磷(P4)或CCl4中所含的共价键数均为0.4NA | |
| B. | S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA | |
| C. | 5.4gAl分别于含溶质0.2mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA | |
| D. | 在H2O2+Cl2═2HCl+O2反应中,每生成32gO2,转移4 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
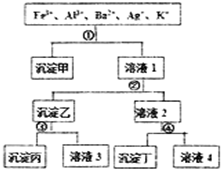 某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3•H2O、NaCl四种溶液,按图所示步骤分开五种离子.下列判断正确的是( )
某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3•H2O、NaCl四种溶液,按图所示步骤分开五种离子.下列判断正确的是( )| A. | 沉淀乙是氢氧化铝和氢氧化银的混合物 | |
| B. | 溶液3中含有Al3+ | |
| C. | 试剂①是NaCl,试剂④是H2SO4 | |
| D. | 溶液4含有三种阳离子,分别是H+、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱电解质需要通电才能发生电离 | |
| B. | 醋酸达到电离平衡时,不存在:CH3COO-+H+?CH3COOH | |
| C. | H2SO4是共价化合物,所以它是弱电解质 | |
| D. | 弱电解质溶液中,既有溶质分子,又有溶质电离出来的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯 | B. | 乙醇和丙醇(CH3CH2CH2OH) | ||
| C. | 乙醇和乙醚(C2H5OC2H5) | D. | 甲醛(HCHO)和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
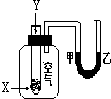 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )| A. | ①②③ | B. | ①③ | C. | ①② | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com