




| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | ③④ |
分析 由非极性键构成的分子,一定为非极性分子;而由极性键构成的分子,若结构对称,正负电荷的中心重合,则为非极性分子,据此分析.
解答 解:根据路易斯结构式可知,① 为CO2,在二氧化碳中,碳氧键为极性键,但由于二氧化碳中两条碳氧键对称,故极性抵消,正负电荷中心重合,故为非极性分子;
为CO2,在二氧化碳中,碳氧键为极性键,但由于二氧化碳中两条碳氧键对称,故极性抵消,正负电荷中心重合,故为非极性分子;
② 中三条键均为极性键,但由于其结构对称,三条键的极性能相互抵消,故为非极性分子;
中三条键均为极性键,但由于其结构对称,三条键的极性能相互抵消,故为非极性分子;
③ 为NH3或PH3,结构中三条键均为极性键,但由于三条键的极性不能相互抵消,故为极性分子;
为NH3或PH3,结构中三条键均为极性键,但由于三条键的极性不能相互抵消,故为极性分子;
④ 为H2O或H2S,结构中两条键均为极性键,但由于两条键的极性不能相互抵消,故为极性分子;
为H2O或H2S,结构中两条键均为极性键,但由于两条键的极性不能相互抵消,故为极性分子;
故选D.
点评 本题考查了键的极性和分子极性之间的关系,应注意的是由极性键构成的是不是极性分子取决于分子的空间构型.


科目:高中化学 来源: 题型:解答题
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75% | 11.44% | 13.56% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 操 作 | 现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若产生①蓝色沉淀, 则②猜想一不成立; |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若③乙醚层呈血红色, 则④猜想二成立; |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锗的原子序数为24 | B. | 锗的金属活动性应比硅强 | ||
| C. | Ge可以生成化学式为Na2GeO3的盐 | D. | 单质锗是半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| D. | 用液溴和苯在催化剂作用下制溴苯: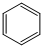 +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢是白色有刺激性气味的气体 | |
| B. | 氯化氢具有强酸性 | |
| C. | 氯化氢能使干燥的蓝色石蕊试纸变红 | |
| D. | 氯化氢极易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | a中试剂 | b中试剂 | 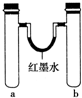 |
| 1 | 0.1g Na、3mL水 | 0.1g Na、3mL乙醇 | |
| 2 | 3mL水 | 3mL饱和FeSO4溶液 | |
| 3 | 3mL浓硝酸、1g铝片 | 3mL浓硝酸、1g铜片 | |
| 4 | 生铁钉、3mL饱和食盐水 | 生铁钉、3mL饱和氯化铵溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com