
【题目】在给定条件下物质间转化均能实现的是
A.MnO2![]() Cl2
Cl2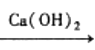 漂白粉
漂白粉
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.S(s) 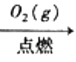 SO3(g)
SO3(g) ![]() H2SO4
H2SO4
D.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3 ![]() Fe(OH)3
Fe(OH)3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是(注:![]() 的绝对值均正确)( )
的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g);△H= —1367.0 kJ/mol(燃烧热)
B.NaOH(aq) + HCl(aq)=NaCl(aq)+ H2O(l);△H= —57.3kJ/mol(中和热)
C.S(s) + O2(g) = SO2(g);△H= —269.8kJ/mol(反应热)
D.2HCl(g)=Cl2(g) + H2(g);△H= — 184.6kJ/mol(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有Na2CO3和NaHCO3两种白色固体物质:
Ⅰ.欲探究Na2CO3和NaHCO3稳定性的相对强弱,两同学分别设计了以下两组装置:

请回答:
①如甲图所示,分别用Na2CO3和NaHCO3做实验,试管②中的试剂是______(填字母序号)。
a. 稀H2SO4 b. NaOH溶液 c. Ca(OH)2溶液
②如乙图所示,试管④中装入的固体应该是______________(填化学式)。
③通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性______(填“强”或“弱”)。
Ⅱ.欲鉴别两种固体物质可选用的试剂是_____________。
Ⅲ.等物质的量浓度的两种物质的溶液与同浓度的盐酸反应,反应速率快的是_________(填化学式)。
(2)甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请回答下列问题:



①实验室制取氨气的化学方程式为:________________________________________;
②三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(假设他们的实验操作都正确),你认为没有收集到氨气的同学是___________(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是___________________________(用化学方程式表示);
③检验氨气是否收集满的方法是(简述操作方法、现象和结论)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态溴原子的价层电子轨道排布图为________。
(2)第四周期中,与溴原子未成对电子数相同的金属元素有________种。
(3)某同学画出基态碳原子的核外电子排布图为![]() ,该电子排布图违背了________。
,该电子排布图违背了________。
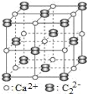
(4)CaC2 中C22-与O22+互为等电子体。
①O22+的电子式可表示为______。
②CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图所示),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长。则CaC2晶体中1个Ca2+周围距离最近的C22-数目为_____。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
①磷化硼晶体晶胞如图甲所示:己知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度(g/cm3)为________(写出计算式即可)。
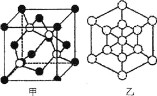
②图甲中![]() 表示P原子,在图乙(磷化硼晶胞沿着体对角线方向的投影)中用
表示P原子,在图乙(磷化硼晶胞沿着体对角线方向的投影)中用![]() 画出P原子的投影位置。__________________________
画出P原子的投影位置。__________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述不正确的是
A.浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA
B.10g46%乙醇水溶液中所含氧原子数为0.4NA
C.1L1mol/LNa2CO3溶液中,阴离子总数小于NA
D.向100mL0.1mol/L醋酸溶液中加入CH3COONa固体至溶液刚好为中性,溶液中醋酸分子数为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明醋酸是弱电解质,下列方法不正确的是( )
A.比较相同物质的量浓度的NaOH溶液和醋酸溶液恰好反应完全时消耗两溶液的体积
B.将1mLpH=3的醋酸溶液稀释到100mL,测其pH小于5
C.比较浓度均为0.1mol·L-1盐酸和醋酸溶液的导电能力
D.测定0.1mol·L-1醋酸溶液的PH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是( )
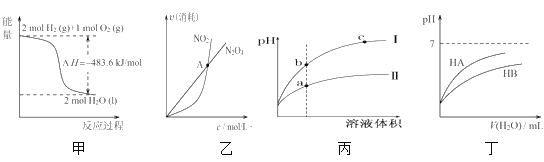
A.由甲可知:热化学方程式是H2(g)+![]() O2(g)=H2O(g)
O2(g)=H2O(g) ![]() H=-241.8kJ/mol
H=-241.8kJ/mol
B.由乙可知:对于恒温恒容条件下的反应2NO2(g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C.由丙可知:相同pH的盐酸和醋酸溶液分别加水稀释,b点溶液的导电性比c点溶液的导电性强
D.由丁可知:同温度、同物质的量浓度的HA溶液与HB溶液相比,其pH前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
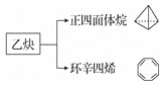
下列说法正确的是( )
A.正四面体烷的分子式为C4H8B.正四面体烷二氯取代产物有1种
C.环辛四烯核磁共振氢谱有2组峰D.环辛四烯与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是重要的还原剂。以铝土矿(主要成分Al2O3,含少量SiO2、Fe2O3等杂质)为原料制备NaAlH4的一种流程如图:
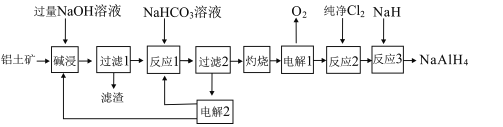
已知:碱浸中SiO2转化成难溶的Na2Al2SixO8
(1)Na2Al2SixO8用氧化物的形式表示为___(x用具体的数值表示)。
(2)过滤1得滤液的主要成分为NaOH和NaAlO2,写出反应1中NaHCO3与NaAlO2反应的离子方程式:___。
(3)电解2生成NaHCO3和NaOH用于循环使用,写出电解2阴极的电极反应式:___。
(4)反应3的化学方程式为___。
(5)铝氢化钠遇水发生剧烈反应产生大量气泡,其反应的化学方程式为___。
(6)滤渣主要成分有Na2Al2SixO8和Fe2O3,可以采用如图流程进行分离:

①滤渣溶于盐酸所得的固体物质可能为___(填化学式)。
②滤渣溶于盐酸的“酸浸率”与温度关系如图所示,试解释温度过高,“酸浸率”降低的原因___。
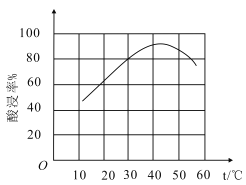
③已知常温下,Ksp[Fe(OH)3]=8.0×10-38,Al3+开始沉淀的pH为4,(溶液中离子的浓度小于1×10-5mol/L为沉淀完全),从滤液中先分离出Fe3+,应调节pH范围为___(lg2≈0.3)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com