
【化学——选修2化学与技术】(15分)
(一)(6分)下列叙述正确的是( )
A.合成氨的“造气”阶段会产生废气
B.电镀的酸性废液用碱中和后就可以排放
C.电解制铝的过程中,作为阳极材料的无烟煤不会消耗
D.使用煤炭转化的管道煤气比直接燃煤可减少环境污染
(二)工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:

(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式: 。
(2)用碱液浸出产品比用热水更好,理由是 。
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。

为使除汞达到最佳效果,应控制条件是 。
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)= mol·L-1。
[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在 ;该电极pH将 (填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因 。
(一)AD(2分)(二)(1)3Na2SO4+8C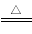 3Na2S+4CO2↑+4CO↑(2分)
3Na2S+4CO2↑+4CO↑(2分)
(2)热水能促进Na2S水解,而稀碱可抑制Na2S水解(2分)(3)pH介于9~10之间,x=12(2分)
(4)4.0×10-36 mol/L(3分) (5)阴极 降低(2分) 2Cu2++2e-+H2O=Cu2O↓+2H+(2分)
【解析】
试题分析:(一)A、合成氨反应的化学方程式为为N2+3H2 2NH3,因此所用的原料气是氮气、氢气。其中氮气来自于空气,氢气来自水和碳氢化合物的反应,用天燃气或煤制备氢气时会产生废气二氧化碳,A正确;B、酸性废液用碱中和后,溶液呈中性,但电镀液中仍然含有重金属离子,随意排放会污染水源和土壤,所以应处理后再排放,B错误;C、电解熔融氧化铝制金属铝时阳极上产生的是氧气,氧气具有氧化性,作为阳极材料的无烟煤会被氧气氧化成二氧化碳,煤会消耗,C错误;D、煤直接燃烧能够产生二氧化硫,从而形成酸雨。煤通过液化气化后,可以提高燃煤的燃烧效率,降低环境污染,D正确,答案选AD。
2NH3,因此所用的原料气是氮气、氢气。其中氮气来自于空气,氢气来自水和碳氢化合物的反应,用天燃气或煤制备氢气时会产生废气二氧化碳,A正确;B、酸性废液用碱中和后,溶液呈中性,但电镀液中仍然含有重金属离子,随意排放会污染水源和土壤,所以应处理后再排放,B错误;C、电解熔融氧化铝制金属铝时阳极上产生的是氧气,氧气具有氧化性,作为阳极材料的无烟煤会被氧气氧化成二氧化碳,煤会消耗,C错误;D、煤直接燃烧能够产生二氧化硫,从而形成酸雨。煤通过液化气化后,可以提高燃煤的燃烧效率,降低环境污染,D正确,答案选AD。
(二)(1)在高温下硫酸钠与碳反应生成等物质的量的CO和CO2,其中C元素化合价从0价升高到+4、+2价,硫酸钠中+6价S元素得到电子,被还原为-2价,化合价降低,则根据电子得失守恒和质量守恒定律可知配平后的化学方程式为3Na2SO4+8C 3Na2S+4CO2↑+4CO↑。
3Na2S+4CO2↑+4CO↑。
(2)硫化钠是强碱弱酸盐,在溶液中硫离子水解显碱性,水解吸热,用热水浸出产品会促进水解,而稀碱溶液能起到抑制水解的作用,所以用碱液浸出产品比用热水更好。
(3)根据图像可知pH介于9~10之间且x=12时汞的除去率最高。
(4)若反应后溶液pH=4,则溶液中氢氧根离子的浓度是10-10mol/L,所以根据氢氧化铜的溶度积常数可知,此时溶液中铜离子浓度是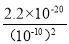 =2.2mol/L,所以根据硫化铜的溶度积常数可知此时溶液中c(S2-)=
=2.2mol/L,所以根据硫化铜的溶度积常数可知此时溶液中c(S2-)=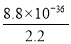 =4.0×10-36 mol/L。
=4.0×10-36 mol/L。
(5)铜离子转化为氧化亚铜,其中铜元素的化合价降低得到电子,因此电解生成Cu2O应在阴极生成;生成氧化亚铜的电解方程式为2Cu2++2e-+H2O=Cu2O↓+2H+,所以该电极溶液的酸性增强,pH降低。
考点:考查化学与技术模块的分析和判断


科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:填空题
(14分)硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和 。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
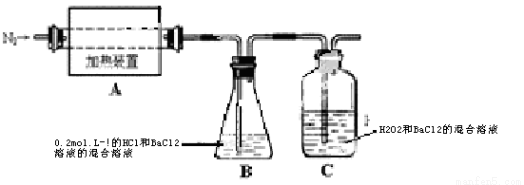
①A中固体充分加热较长时间后,通入氮气,目的是 。
②为验证A中残留物是否含有FeO,需要选用的试剂有 。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有 气体生成,若含有该气体,观察到的现象为 。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则
b a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)。
(3)已知亚铁离子被氧气氧化的反应是:4Fe2+ + O2 + (4+2x) H2O 2Fe2O3?xH2O + 8H+,硫酸亚铁铵 溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
2Fe2O3?xH2O + 8H+,硫酸亚铁铵 溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:选择题
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色。

则下列说法中不正确的是
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
实验室制Cl2的反应为4HCl(浓)+MnO2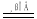 MnCl2+C12↑+2H2O.下列说法错误的是
MnCl2+C12↑+2H2O.下列说法错误的是
A.还原剂是HCl,氧化剂是MnO2
B.每生成1 molCl2,转移电子的物质的量为2 mol
C.每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
将15g两种金属的混合物投入足量的盐酸中,反应完全后得到H2 11.2L(标准状况)该混合物的组成可能是
A.钠和铁 B.镁和铜 C.铝和镁 D.锌和铁
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:选择题
某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子。若向其中加入过氧化钠粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是
A.CO32-、NO3- B.NO3-
C.SO32-、NO3- D.CO32-、NO3-、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)过渡金属元素铁能形成多种配合物,如:K3[Fe(SCN)6] [硫氰合铁(Ⅲ)酸钾]和Fe(CO)x等。
(1)①基态Fe3+的M层电子排布式为 。
②请解释+3价铁的化合物较+2价铁的化合物稳定的原因 。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x = 。
(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为 。
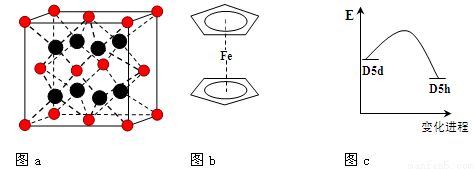
(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键。二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种。
①二茂铁的分子式为 。
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷。因此每个环含有 个π电子。
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8 ~ 20 kJ/mol。温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c。比较稳定的
是 结构(填“重叠”或“错位”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:
2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高一上学期期中考试化学试卷(解析版) 题型:填空题
(3分)木炭与浓硫酸反应可表示为:C +2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(1)木炭作 (填“氧化剂”或“还原剂”),硫酸 (填“被氧化”或“被还原”)。
(2)若消耗了1 mol H2SO4,则生成 mol SO2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com