
| A、向0.02mol?L-1 CH3COOH溶液中加入等体积0.01mol?L-1 NaOH溶液,测得溶液中c(CH3COO-)>c(Na+),则水的电离程度比纯水的大 |
| B、25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c(OH-)=1×10-8mol?L-1 |
| C、等物质的量浓度的NH4Cl溶液和NH3?H2O溶液中,c(NH4+)前者小于后者 |
| D、等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
| 1×10-14 |
| 10-8 |
| 1×10-14 |
| 10-8 |


科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c/(mol?L-1) | V/mL | c/(mol?L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:
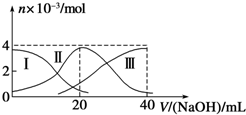 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| B、等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水小 |
| C、NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) |
| D、向上述加入20mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、17g羟基(-OH)所含有的电子数是10NA个 |
| B、1mol苯乙烯中含有的碳、碳双键数为4NA个 |
| C、常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
| D、4.2g C3H6中含有的碳碳双键数一定为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
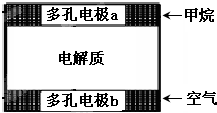 一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )
一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )| A、电极a反应式为:CH4+5O2--8e-=CO32-+2H2O |
| B、电极b是正极,O2-由电极a流向电极b |
| C、瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D、当固体电解质中有1mol O2-通过时,电子转移4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、推广使用一次性木筷,减少疾病传染 |
| B、推广使用电动汽车、天然气汽车等环保公共交通工具 |
| C、大力发展太阳能和风力发电机可缓解电力紧张问题 |
| D、将地沟油回收加工为燃料油,提高资源的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤. | 除去Mg(OH)2样品中的Ca(OH)2 |
| B | 取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液. | 检验KClO3中的氯元素 |
| C | 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失. | 说明原溶液中一定含有CO32-或SO32- |
| D | 向盛有1mL 0.011mol?L-1AgNO3溶液的试管中滴加5滴0.01mol?L-1NaCl溶液,有白色沉淀生成,再向其中滴加0.01mol?L-1NaI溶液,产生黄色沉淀. | 常温下, Ksp(AgCl)>Ksp(AgI) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有阴离子的化合物一定含有阳离子,含有阳离子的化合物不一定含有阴离子 |
| B、只含化学键而无分子间作用力的化合物晶体一定是原子晶体 |
| C、质子数和电子数均相同的两种微粒不可能是一种分子和一种离子 |
| D、只有分子中所有原子均达到2个或8个电子稳定结构的分子才是稳定分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com