
【题目】在恒容绝热密闭容器中发生CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是( )
2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是( )
①容器内混合气体的平均相对分子质量不再变化;②容器内气体密度不再发生变化;
③容器内气体的压强不再发生变化; ④v正(NO):v逆(N2):v逆(CO2)=4:2:1;
A.①②③B.③④C.①②③④D.②③④
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】有一可逆反应:2A(g)+3B(g) ![]() xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应:①0.8 mol A+1.2 mol B+1.2 mol C+2.4 mol D②1.4 mol A+2.1 mol B+0.6 mol C+1.2 mol D达平衡后,C的质量分数相等,则方程式中x的值为( )
xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应:①0.8 mol A+1.2 mol B+1.2 mol C+2.4 mol D②1.4 mol A+2.1 mol B+0.6 mol C+1.2 mol D达平衡后,C的质量分数相等,则方程式中x的值为( )
A. 1B. 2C. 3D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
B. 1mol硝基(-NO2)与46g二氧化氮所含的电子数均为23NA
C. 16.2g14C10H22中含有的共价键数目为3.2NA
D. 向含1molFeI2的溶液中通入1molCl2充分反应,该反应转移电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法或操作正确的是( )
A.用标准氢氧化钠溶液滴定待测醋酸,选用酚酞作指示剂
B.配制![]() 溶液时,将
溶液时,将![]() 固体溶解在硫酸中,然后再加水稀释到所需的浓度
固体溶解在硫酸中,然后再加水稀释到所需的浓度
C.测定某溶液的pH时,用pH试纸蘸取待测液,然后和比色卡对比得出pH
D.将淀粉溶液加到饱和食盐水中,检验食盐是否是加碘食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=-2×57.3kJ·mol-1
B.101kPa时,H2的热值为142.75kJ·g-1,则表示氢气标准燃烧热的热化学方程式为:H2(g)+![]() O2(g)=H2O(l) ΔH=-142.75kJ·mol-1
O2(g)=H2O(l) ΔH=-142.75kJ·mol-1
C.由C(金刚石)=C(石墨) ΔH=-1.9kJ·mol-1可知,金刚石比石墨稳定
D.同温同压下,4Al(s)+3O2(g)=2Al2O3(s)在常温和点燃条件下的ΔH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材中给出了Na2O2与水反应的化学方程式,某学习小组通过实验研究Na2O2与水发反应机理
操作 | 现象 |
Ⅰ | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
Ⅱ | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
Ⅲ | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
(1)Na2O2的电子式为 ______ ,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表示反应的机理,写出Na218O2与H2O反应的化学方程式 ______ .
(2)操作Ⅱ中红色褪去的可能原因是 ______ .
(3)用反应![]() 测定溶液a中H2O2含量.取20.00ml溶液a,用稀 ______
测定溶液a中H2O2含量.取20.00ml溶液a,用稀 ______ ![]() 填化学式
填化学式![]() 酸化,用0.002molL-1KMnO4溶液滴定,至终点时平均消耗10.00ml KMnO4溶液.滴定时KMnO4溶液应装在 ______
酸化,用0.002molL-1KMnO4溶液滴定,至终点时平均消耗10.00ml KMnO4溶液.滴定时KMnO4溶液应装在 ______ ![]() 填酸或碱
填酸或碱![]() 式滴定管中,终点确定的方法是 ______ ,经计算溶液a中c(H2O2)= ______ molL-1
式滴定管中,终点确定的方法是 ______ ,经计算溶液a中c(H2O2)= ______ molL-1
(4)向溶液a中滴加FeSO4溶液,发生反应的离子方程式为______ .
(5)向FeSO4溶液中加入一定量Na2O2固体,并以物质的量为2:1发生反应,反应中无气体生成,写出反应的离子方程式 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某传感器工作原理如图所示。利用该传感器可以测定空气中NO、CO、NH3、SO2等有害气体的含量。下列说法正确的是
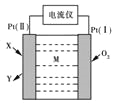
A. 传感器工作中,电子由Pt(Ⅰ)极经电流仪传到Pt(Ⅱ)极
B. 若M为熔融KOH,X为NH3,Y为N2,则负极的电极反应式为2NH3-6e- = N2+6H+
C. 若M是含O2-的固体电解质,X为NO,则正极的电极反应式为O2 + 4e- = 2O2-
D. 若X为CO,M为KOH溶液,则电池总反应为2CO+O2 = 2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:

步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式_________________________________。
(2)上图装置中NaOH溶液的作用是____________________________________。
(3)步骤二中,水浴加热所需仪器有____________、____________(加热、夹持仪器、石棉网除外),水浴加热的优点是_________________________________。
(4)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )

A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com