
| A�� | ��A��B����Ԫ���γɵĻ�����BA5�к����ۼ� | |
| B�� | ��C��EԪ�ص�ijЩ���ʾ���ɱ�����������ã���ԭ����ͬ | |
| C�� | ԭ�Ӱ뾶��D��C��B�����Ӱ뾶B��C��D | |
| D�� | ��A��C��E����Ԫ���γɵ�ij�ֻ�����AEC����ṹʽA-E-C |
���� A��B��C��D��E��ԭ������������������ֶ�����Ԫ�أ�C��A��B��D�����γ�ԭ�Ӹ�����Ϊ1��1��1��2���������X��Y��X����ΪNO��CO��H2O2��Na2O2��Y����ΪNO2��CO2��H2O��Na2O��A��ԭ��������С������AΪ��Ԫ�أ�E��ԭ���������E��ij�ֺ��������������һ�������¿ɷֽ�����C�ĵ��ʣ�Ϊ������ķֽ⣬��CΪOԪ�أ�A��B�����ĵ�����֮����C��������������ȣ�CΪOԪ�أ���BΪNԪ�أ�DΪNa��A����A��B����Ԫ���γɵĻ�����NH5�У�笠������к��й��ۼ���
B������������ˮ����ɱ�����������ã���ԭ����ͬ��
C�����Ӳ����࣬�뾶��ͬ����Ԫ�ش�����ԭ�Ӱ뾶��С����������ͬ�ĵ��Ӳ�ṹ�����ӣ��˵����Խ�뾶ԽС��
D����A��C��E����Ԫ���γɵ�ij�ֻ�����AECΪ�����ᣬ���ݴ�����Ľṹ��ʽ�жϣ�HClO��Clԭ��ֻ�γ�1�����ۼ���
��� �⣺AΪ��Ԫ�أ�BΪNԪ�أ�CΪOԪ�أ�DΪNaԪ�أ�EΪCl��
A���ǽ���Ԫ��֮�����γɹ��ۼ�����A��B����Ԫ���γɵĻ�����NH4H�У�笠������к���N-H���ۼ�����A��ȷ��
B����C��O3����EԪ�ص���ˮ��������ǿ�����ԣ�����ɱ�����������ã���ԭ����ͬ����B��ȷ��
C��BΪNԪ�أ�CΪOԪ�أ�DΪNaԪ�أ����Ӱ뾶B��C��D�����Ӳ����࣬�뾶��ԭ�Ӱ뾶��Na��O��ͬ����Ԫ�ش�����ԭ�Ӱ뾶��С���뾶N��O��ԭ�Ӱ뾶��D��B��C��
��C����
D����ԭ������������Ϊ7���γ�1�Թ��õ��Ӷԣ���ԭ������������Ϊ6���γ�2�Թ��õ��Ӷԣ��������������ԭ�ӷֱ�ͨ��1�Թ��õ��Ӷ�����ԭ�ӡ���ԭ�ӽ�ϣ�������ṹʽΪH-O-Cl����D����
��ѡAB��
���� ���⿼��ṹ����λ�ù�ϵӦ�ã����ؿ���ѧ���ķ���������������������Ԫ�������ɣ�������ѧ���Ի���֪ʶ�����գ��ƶ�Ԫ���ǽ���Ĺؼ�����Ŀ�Ѷ��еȣ�


 ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
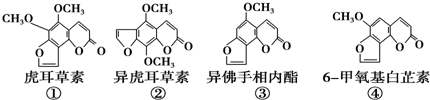
| A�� | �ڡ��ۻ�Ϊͬϵ�� | |
| B�� | �١��۸�1mol����������������Һ��Ӧʱ������3molNaOH | |
| C�� | �����ʵ����Ģڡ��ֱܷ���������������ȫȼ�գ�ǰ�����������Ⱥ����� | |
| D�� | �ۡ��ܻ�Ϊͬ���칹�壬���Ǹ�1mol������5molH2�ӳ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
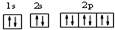 ��
��ʱ��/h �۳��� �¶� | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 800�� | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
| 830�� | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 860�� | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
| 950�� | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| �ζ����� | ����Һ�����mL�� | ��NaOH��Һ�����mL�� | |
| �ζ�ǰ������mL�� | �ζ��������mL�� | ||
| ��һ�� | 25.00 | 10.80 | 30.70 |
| �ڶ��� | 25.00 | 14.20 | 34.30 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�ش��� | A | B | C | D | E | F | G | H |
| ԭ�Ӱ뾶/pm | 37 | 160 | 70 | 66 | 186 | 143 | 104 | 99 |
| ����ϼ� | +1 | +2 | +5 | +1 | +3 | +6 | +7 | |
| ��ͻ��ϼ� | -3 | -2 | -2 | -1 |
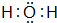 ��B��H����Ԫ���γɻ�����ĵ���ʽ��
��B��H����Ԫ���γɻ�����ĵ���ʽ��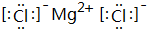 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
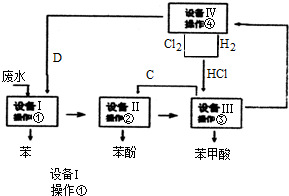
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com