
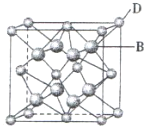
 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示.请回答下列问题:
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示.请回答下列问题:| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 6-2 |
| 2 |
| 6-2×3 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 4×78g/mol |
| NAmol-1 |
| ||
| a g?cm-3 |
| 4×78 |
| a×NA |
| 4×78 |
| a×NA |


科目:高中化学 来源: 题型:
| A、用浓硫酸配制一定浓度的稀硫酸时,用量筒量取浓硫酸倒入盛水的烧杯中稀释,且用水洗涤量筒,洗涤液一并注入烧杯 |
| B、除去Fe(OH)3胶体中混有的Cl-离子,可用渗析的方法 |
| C、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 |
| D、NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、18g NH
| ||
| B、1mol 任何气体的体积都约是22.4L | ||
| C、NA个H2SO4分子的质量等于H3PO4的摩尔质量 | ||
| D、标准状况下,相同体积的O2、HCl、H2O含有的分子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质既可与盐酸反应,又可与NaOH溶液反应 |
| E | 原子最外层电子数比次外层电子数少1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
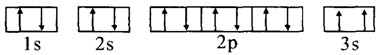
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素. |
| B元素原子的核外p电子数比s电子数少1. |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满. |
| E元素的主族序数与周期数的差为4. |
| F是前四周期中电负性最小的元素. |
| G在周期表的第七列. |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
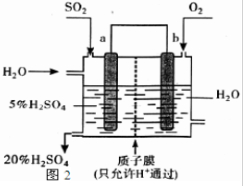
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属氧化物不一定是酸性氧化物,金属氧化物不一定为碱性氧化物 |
| B、联合制碱法在滤出NaHCO3后,为使滤液中NH4Cl析出更多更纯,通氨气加食盐冷却 |
| C、发生化学反应时失去电子数越多的金属原子,还原能力不一定越强 |
| D、氯水、Na2O2、活性炭都能使品红溶液褪色,但原理彼此都不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com