
| A. | 氧气 | B. | 硫磺 | C. | 木炭 | D. | 硝酸钾 |
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH2Cl+HCl | B. | 2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | ||
| C. | CH2=CH2+Br2$\stackrel{一定条件}{→}$CH2BrCH2Br | D. | 3NO2+H2O═2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
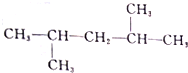 ⑪
⑪ ⑫
⑫
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能与高锰酸钾发生取代反应而使酸性高锰酸钾溶液褪色 | |
| B. | 苯能与高锰酸钾发生取代反应而使酸性高锰酸钾溶液褪色 | |
| C. | 乙烯能与溴单质发生加成反应而使溴水褪色 | |
| D. | 苯能与溴单质发生加成反应而使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应液使酚酞试液变红色 | B. | 反应液使蓝色石蕊试纸变红色 | ||
| C. | 有大量固体析出 | D. | 反应后静置,反应液不分层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 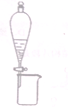 分离乙醇和乙酸乙酯 | |
| B. | 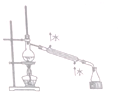 分离苯和甲苯 | |
| C. | 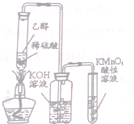 实验室制备,收集乙烯并验证其易被氧化 | |
| D. |  实验室制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不-定存在K+ | B. | 100mL溶液中含有0.02molCO32- | ||
| C. | 可能存在Cl- | D. | 一定不存在Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
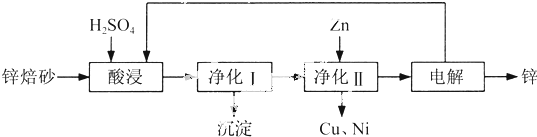
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com