
| ||
| ||


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
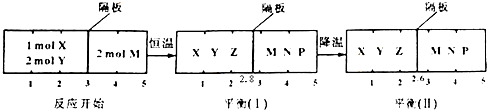
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖作为营养剂供给人体能量,在体内发生的主要反应是氧化反应 |
| B、药物能治疗疾病,故多吃点没关系 |
| C、鸦片、吗啡、海洛因等毒品危害极大,人们特别是青少年一定要远离毒品 |
| D、为了预防、治疗疾病,家庭应自备一些常用的非处方药,以供急用 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li是最活泼的金属,F是最活泼的非金属 |
| B、Mg(OH)2碱性比Ca(OH)2强 |
| C、元素周期表中有7个主族,7个副族,1个0族,1个第Ⅷ族,共16纵行 |
| D、X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com