
如右图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细,下表所列M、N、P物质中,可以组合成该装置的 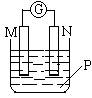 是
是
选项号 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
科目:高中化学 来源: 题型:
 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.| 11 |
| 3 |
| 11 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 7 |
| m1 |
| 7 |
| m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
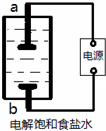 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:查看答案和解析>>
科目:高中化学 来源: 题型:
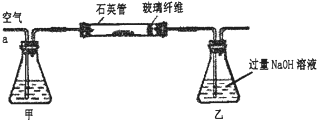
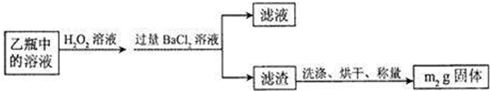
(6分)实验室常用如右图所示装置来进行铜跟浓硫酸反应等一系列实验。
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成____________。根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成__________。写出甲装置中发生的主要反应的化学方程式_____________。
(2)你在实验室中进行这个实验时,除了(1)小题中指到的实验现象外,还可以观察到许多其它的实验现象,请写出两种:__________、_____________。
(3)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com