
【题目】室温下如图,关闭活塞,在左右两室(体积相同)各充入一定量H2和Cl2,且恰好使两容器内气体密度相同,打开活塞,点燃使H2与Cl2充分反应生成氯化氢气体:H2+Cl2=2HCl,恢复到原温度后,下列判断正确的是

A. 开始时左右两室分子数相同
B. 最终容器内无H2存在
C. 反应前后H2室压强相同
D. 最终容器内密度与原来相同
科目:高中化学 来源: 题型:
【题目】化学试剂应根据其性质和形态进行有效妥善保存:
(1)固体试剂应保存在____________中,液体试剂保存在____________中,见光易分解的试剂(如:浓HNO3、AgNO3等)应用____________色试剂瓶保存。氢氟酸(HF)因和玻璃中的SiO2强烈反应而腐蚀玻璃,应用____________存放;金属钠、钾应保存在____________中;少量白磷应该保存在____________中。
(2)新制氯水需保存在棕色试剂瓶中,原因是__________________。
(3)实验室新配制的硫酸亚铁溶液,一般要加入少量___________,防止在空气中变质。
(4)在盛放浓硫酸的试剂瓶标签上印如下列警示标记,说明浓硫酸具有_______性。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中所示的装置图能够达到实验目的是
A.  用图A所示配制一定浓度的稀硫酸
用图A所示配制一定浓度的稀硫酸
B.  用图B装置,实验室制备Fe(OH)2
用图B装置,实验室制备Fe(OH)2
C.  用图C所示实验,可比较氯、碳、硅三种元素的非金属性强弱
用图C所示实验,可比较氯、碳、硅三种元素的非金属性强弱
D.  用图D加热熔融NaOH固体
用图D加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g)===Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
A. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
B. 反应过程中,若增大压强能提高SiCl4的转化率
C. 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
D. 反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:

回答下列问题:
(l)反应![]() 的△H= _________ kJ/mol 。
的△H= _________ kJ/mol 。
(2)解聚反应在刚性容器中进行。
①其他条件不变,有利于提高双环戊二烯平衡转化率的条件是 ____ (填标号).
A.升高温度 B.降低温度 C.增大压强 D.减小压强
②实际生产中常通入水蒸气以降低双环戊二烯的沸点。某温度下,通入总压为l00kPa的双环戊二烯和水蒸气,达到平衡后总压为160kPa,双环戊二烯的转化率为8 0%,则 pH2O=___kpa,平衡常数Kp=______kPa (Kp为以分压表示的平衡常数)
(3) 一定条件下,将环戊二烯溶于有机溶剂中进行氢化反应,反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如下图所示。

①将环戊二烯溶于有机溶剂中可减少二聚反应的发生,原因是____,
②最佳的反应时间为__h。活化能较大的是__(填“氢化反应”或“副反应”)。
(4)已知氢化反应平衡常数为1.6 × 1012,副反应的平衡常数为2.0×10l2。在恒温恒容下,环戊二烯与氢气按物质的量之比为1:1进行反应,则环戊二烯的含量随时间变化趋势是____(不考虑环戊二烯的二聚反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4 )2Cr2O7的部分性质及组成进行探究。
已知:Cr2O72-(橙色)+ H2O 2CrO42-(黄色)+2H+。请回答下列问题:
⑴在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓K0H溶液,振荡、微热,观察到的主要现象是________。
⑵为探究(NH4)2Cr2O7 (摩尔质量为252 g/mol)的分解产物,按下图连接好装置,在A中加入5.040 g样品进行实验。
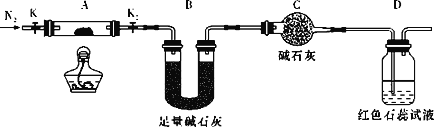
①仪器C的名称是______________。
②连接好装置,点燃酒精灯之前,需进行的必要操作是_________________________。
③反应结束后,依然要通一段时间的氮气的原因是_______________________。
④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为Cr2O3、B中质量的变化为1.44 g,写出重铬酸铵加热分解反应的化学方程式:_________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数(杂质不发生反应),其反应原理为 2Ba2++Cr2O72- + H2O = 2BaCrO 4↓+2H+、4NH4++6HCHO = 3H++6H2O+(CH2)6N4H+ [滴定时,1 mo1 (CH2)6N4H+ 与 1 mo1 H+ 相当],然后用 NaOH 标准溶液滴定反应生成的酸。
实验步骤:称取样品5.600 g,配成500 mL溶液,移取25.00 mL样品溶液于 250 mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10 mL 20.00 mol·L-1的中性甲醛溶液,摇匀、静置5 min后,加入12滴酚酞试液,用0.200 mo1 L-1 NaOH 标准溶液滴定至终点。重复上述操作3次,最终滴定用去Na0H标准溶液体积的平均值为20.00 mL。
①若滴定终点时,仰视读数,则测定结果__________(填“偏大” “偏小”或“无影响”)。
②滴定计算得该样品中氮的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X(g)+2Y(g)![]() Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100 mol·L-1,c(Y)=0.200 mol·L-1,c(Z)=0 mol·L-1。反应物X的浓度随时间的变化如图所示。
Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100 mol·L-1,c(Y)=0.200 mol·L-1,c(Z)=0 mol·L-1。反应物X的浓度随时间的变化如图所示。
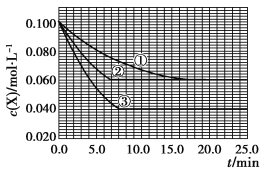
下列说法正确的是
A. 若反应①、②的平衡常数分别为K1、K2,则K1<K2
B. 实验②平衡时Y的转化率为60%
C. 减小反应③的压强,可以使平衡时c(X)=0.060 mol·L-1
D. 反应X(g)+2Y(g) ![]() Z(g)的ΔH>0
Z(g)的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写下列描述中所发生化学反应的离子方程式
(1)稀硫酸与氢氧化钡反应:_________________________________。
(2)向澄清石灰水中加入少量碳酸氢钠溶液:___________________________。
(3)向硫酸氢钠溶液中加氢氧化钠溶液至中性:____________________。
(4)生活中可以用醋酸除去水垢:________________________________________。
(5)西汉刘安《淮南万毕术》中记载“曾青得铁则化为铜”,是湿法炼铜的最早描述:______________________。
(6)向饱和的碳酸钠溶液中通入CO2生成碳酸氢钠的沉淀______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,a g甲气体和2a g乙气体所占体积之比为1∶2,甲和乙的密度之比为______。
(2)二氧化硫、氢气、二氧化碳组成的混合气体在同温、同压下与笑气(N2O)的密度相同,则该混合气体中二氧化硫、氢气、二氧化碳的体积比可能为_______(填字母)。
A.42:20:13 B.22:1:14 C.13:8:13 D.21:10:12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com