
【题目】已知质量分数为98%的浓硫酸,密度为1.84g/mL,下列有关说法不正确的是
A. 该硫酸物质的量浓度为18.4mol/L
B. 取10mL该溶液,加等质量的水混合后,所得硫酸物质的量浓度小于9.2mol/L
C. 取10g该溶液,加入等体积水混合后,所得硫酸质量百分比浓度大于49%
D. 将该硫酸盛放在U型干燥管中,可用来干燥H2、SO2、H2S等气体
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关,下列说法正确的是( )
A. 聚乙烯塑料的老化是因为发生了加成反应
B. 煤经过气化和液化等物理变化可转化为清洁燃料
C. 合成纤维、人造纤维及碳纤维都属于有机高分子材料
D. 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2
的成功范例。在尿素合成塔中的主要反应可表示如下:
反应 I:2NH3(g)+CO2(g) ![]() NH2COONH4(s) ΔH1=-159.47 kJ·mol-1
NH2COONH4(s) ΔH1=-159.47 kJ·mol-1
反应II:NH2COONH4(s) ![]() CO(NH2)2(s)+H2O(g) ΔH2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.49kJ·mol-1
请回答下列问题:
(l)写出CO2和NH3为原料生成尿素和气态水的热化学反应方程式_______,反应II自发进行的条件是_____。
(2)CO2和NH3为原料合成尿素的反应中影响CO2转化率的因素很多,下图为某待定条件下,不同水碳比[n(H2O)/n(CO2)]和温度影响CO2转化率变化的趋勢曲线。

下列说法不正确的是__________。
A.温度升髙该反应平衡常数逐渐减小,移走部分尿素平衡向正方向移动
B.当温度低于190℃,随温度升髙CO2转化率逐渐增大,其原因可能是温度升高平衡向正方向移动
C.当温度髙于190℃后,随温度升髙CO2转化率逐渐减小,其原因可能是温度升高发生了副反应
D.其他条件相同时,为提髙CO2的转化率,生产中可以采取的措施是提高水碳比
(3)某研究小组为探究反应I中影响C(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡,其c(CO2)随时间t变化趋势曲线如下图所示。则其逆反应的平衡常数为_____。若其他条件不变,t1时将容器体积压缩到1L,请画出t1t2时间段C(CO2)随时间t变化趋势曲线(t2时达到新的平衡)。__________

(4)电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如下图,请写出在A电极上发生的电极反应式_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度,相同物质的量浓度的4种溶液( )
①CH3COONa ②NaHSO4 ③NaCl ④Na2CO3
按pH由大到小的顺序排列,正确的是
A.④>①>③>②B.①>④>③>②
C.①>②>③>④D.④>③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3﹣>I﹣,氧化性IO3﹣>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.
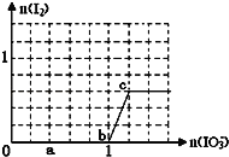
(1)a点时消耗NaHSO3的物质的量为_____mol,假设反应中无SO2逸出。
(2)从b点开始计算,当生成0.3mol I2时,转移电子数为_______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知反应:2SO2(g) + O2(g)![]() 2SO3(g),反应速率v(SO2)=0.05mol·L-1·min-1,则v(O2) =___________ mol·L-1·min-1。
2SO3(g),反应速率v(SO2)=0.05mol·L-1·min-1,则v(O2) =___________ mol·L-1·min-1。
(2)已知:2SO2(g) + O2(g)![]() 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的 △H=___________kJ·mol-1。
SO3(g)+NO(g)的 △H=___________kJ·mol-1。
(3)一定温度下,将NO2与SO2以体积比1∶2 置于容积固定的密闭容器中发生(2)中反应,下列事实能说明反应达到化学平衡状态的是___________(填正确选项字母编号)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2和SO2的体积比保持不变 d.△H保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的转化通过一步反应不能实现的是( )
A.HCl →Cl2→HClO→NaClO
B.Na→Na2O2→Na2CO3→NaHCO3
C.Si→SiO2→H2SiO3→Na2SiO3
D.Al→NaAlO2 →Al(OH)3→Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙和X是4种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是
![]()
A. 甲为C,X是O2 B. 甲为CO2,X是NaOH溶液
C. 甲为Cl2,X为Fe D. 甲为Na,X为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
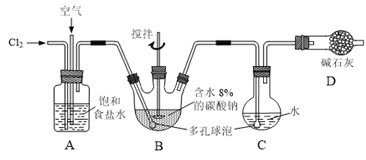
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是______。
②为使反应充分进行,实验中采取的措施有______。
(2)①写出装置B中产生Cl2O的化学方程式并用单线桥法标出电子转移的方向和数目:______。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是______。
(3)装置C中采用棕色圆底烧瓶是因为______。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用酸式滴定管准确量取20.00 mL次氯酸溶液,______。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com