
分析 (1)根据Ksp(BaSO4)=1×10-10计算;
(2)从影响难溶电解质的溶解平衡的角度分析,结合溶度积计算;
(3)①CaSO4 转化为CaCO3的离子方程式为CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq);
②从沉淀的转化角度分析.
解答 解:(1)将浓度均为0.1mol/L的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中为饱和溶液,则存在:c(Ba2+)×c(SO42-)=1×10-10,c(Ba2+)=1×10-5mol/L;
取100mL滤液与100mL2mol/LNa2SO4的溶液混合,反应后c(SO42-)=1mol/L,则由c(Ba2+)×c(SO42-)=1×10-10可知:c(Ba2+)=1×10-10mol/L,
故答案为:1×10-5;1×10-10;
(2)由平衡BaSO4(s)?Ba2+(aq)+SO42-(aq)可知,H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动,
c(SO42-)=0.5mol/L,则由c(Ba2+)×c(SO42-)=1×10-10可知:c(Ba2+)=$\frac{1×1{0}^{-10}}{0.5}$=2×10-10mol/L,
故答案为:对于平衡BaSO4(s)?Ba2+(aq)+SO42-(aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动;2×10-10;
(3)①CaSO4 转化为CaCO3的离子方程式为CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),
故答案为:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq);
②由平衡CaSO4(s)?Ca2+(aq)+SO42-(aq)可知,加入Na2CO3溶液后,CO32-与Ca2+结合生成CaCO3沉淀Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动,发生:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),
故答案为:CaSO4存在沉淀溶解平衡,加入Na2CO3溶液后,CO32-与Ca2+结合生成CaCO3沉淀Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动.
点评 本题考查难溶电解质的溶解平衡,题目难度较大,解答本题时注意根据溶度积计算,把握平衡移动原理,注重相关知识、方法的理解和把握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
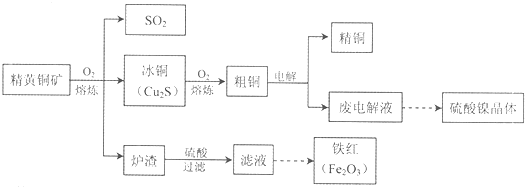
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
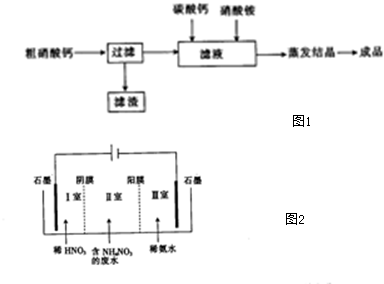
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
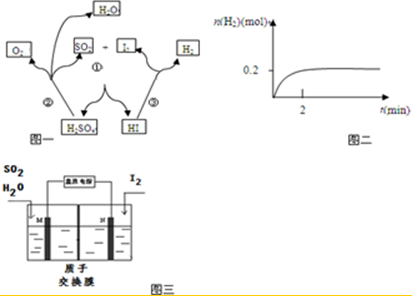
| 温度 | 元素存在形式 |
| 1 200-1 350K | Fe3+部分转变为Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的摩尔质量为27g | |
| B. | 常温常压下,46g NO2中含有的氧原子数为2NA | |
| C. | 标准状况下,22.4L水中所含有的水分子数NA | |
| D. | 0.1mol•L-1的MgCl2溶液中氯离子物质的量浓度为0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
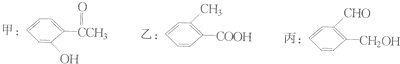
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl-离子的结构示意图: | |
| B. | 中子数为18的氯原子:${\;}_{17}^{35}$Cl | |
| C. | 铁在氯气中燃烧:Fe+Cl2=FeCl2 | |
| D. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com