
【题目】镍的全球消费量仅次于铜、铝、铅、锌,居有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:Ni(CO)4(g)![]() Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。
Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。
已知:CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸;Fe(CO)5熔点-20℃,沸点103℃。

回答下列问题:
(1)装置A中发生反应的化学方程式为__。
(2)装置C用于合成Ni(CO)4夹持装置略,最适宜选用的装置为__(填标号)。

(3)实验过程中为了防止__,必须先观察__。
(4)制得的Ni(CO)4中常溶有Fe(CO)5等杂质,提纯的方法是__(填标号)。
A.分液 B.蒸馏 C.过滤 D.重结晶
(5)利用“封管实验”原理可获得高纯镍。如图所示的石英玻璃封管中充有CO气体,则高纯镍粉在封管的__温度区域端生成(填“323K”或“473K”)。

(6)实验中加入11.50gHCOOH,C装置质量减轻2.95g设杂质不参加反应 ,E装置中盛有PdCl2溶液100mL,则PdCl2溶液的物质的量浓度至少为__molL-1(填实验现象再加热C装置)。
【答案】HCOOH![]() H2O+CO↑ ③ CO及Ni(CO)4与装置中空气混合在加热条件下会发生爆炸 E装置中生成黑色沉淀 B 473K 0.50
H2O+CO↑ ③ CO及Ni(CO)4与装置中空气混合在加热条件下会发生爆炸 E装置中生成黑色沉淀 B 473K 0.50
【解析】
(1)装置A中甲酸与在浓硫酸的作用下生成CO和水;
(2)温度在50~80℃是更有利于Ni(CO)4的生成;
(3)CO 及 Ni(CO)4 与装置中空气混合在加热条件下会发生爆炸;
(4)Ni(CO)4沸点 43℃,Fe(CO)5沸点 103℃;
(5)323K是49.85℃,473K是199.85℃,根据方程式Ni(CO)4 (g)![]() Ni(s)+4CO(g)可知180~200℃时生成Ni单质;
Ni(s)+4CO(g)可知180~200℃时生成Ni单质;
(6)n(HCOOH)=![]() =0.25mol,则生成的n(CO)=0.25mol,C装置中发生Ni(s)+4CO(g)
=0.25mol,则生成的n(CO)=0.25mol,C装置中发生Ni(s)+4CO(g)![]() Ni(CO)4(g),则C管减轻的质量即反应的Ni的质量,则反应n(Ni)=
Ni(CO)4(g),则C管减轻的质量即反应的Ni的质量,则反应n(Ni)=![]() =0.05mol,则消耗n(CO)=0.2mol,所以PdCl2 溶液至少要吸收CO的物质的量为0.25mol-0.2mol=0.05mol,根据方程式CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl可得。
=0.05mol,则消耗n(CO)=0.2mol,所以PdCl2 溶液至少要吸收CO的物质的量为0.25mol-0.2mol=0.05mol,根据方程式CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl可得。
(1)装置A中甲酸与在浓硫酸的作用下生成CO和水,反应方程式为HCOOH![]() H2O+CO↑;
H2O+CO↑;
(2)温度在50~80℃时更有利于Ni(CO)4的生成,为了更好的控制温度,且可避免温度过高,可选用水浴加热,所以选用③装置;
(3)CO 及 Ni(CO)4 与装置中空气混合在加热条件下会发生爆炸,所以要先观察到E装置中生成黑色沉淀,再加热C装置;
(4)Ni(CO)4沸点 43℃,Fe(CO)5沸点 103℃,可采用蒸馏的方法进行提纯,故答案为B;
(5)323K是49.85℃,473K是199.85℃,根据方程式Ni(CO)4 (g)![]() Ni(s)+4CO(g)可知180~200℃时生成Ni单质,所以高纯镍粉在封管的473K温度区域端生成;
Ni(s)+4CO(g)可知180~200℃时生成Ni单质,所以高纯镍粉在封管的473K温度区域端生成;
(6)n(HCOOH)=![]() =0.25mol,则生成的n(CO)=0.25mol,C装置中发生Ni(s)+4CO(g)
=0.25mol,则生成的n(CO)=0.25mol,C装置中发生Ni(s)+4CO(g)![]() Ni(CO)4(g),则C管减轻的质量即反应的Ni的质量,则反应n(Ni)=
Ni(CO)4(g),则C管减轻的质量即反应的Ni的质量,则反应n(Ni)=![]() =0.05mol,则消耗n(CO)=0.2mol,所以PdCl2 溶液至少要吸收CO的物质的量为0.25mol-0.2mol=0.05mol,根据方程式CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl可知所需n(PdCl2)=0.05mol,所以其浓度至少为
=0.05mol,则消耗n(CO)=0.2mol,所以PdCl2 溶液至少要吸收CO的物质的量为0.25mol-0.2mol=0.05mol,根据方程式CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl可知所需n(PdCl2)=0.05mol,所以其浓度至少为![]() =0.5mol/L。
=0.5mol/L。


科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1>0,△H3<0
B. △H2>0,△H4>0
C. △H1=△H2+△H3
D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,近年来我国着力推进绿色发展、循环发展等,形成节约资源和环境保护的空间格局。
Ⅰ.为了寻求对环境无污染燃料燃烧法,有人曾研究了在标准条件下氮的氧化物与碳的氧化物相互作用的机理。
(1)确定该反应的反应过程如下:
第一步:NO2(g)+CO(g)→O—N…O…C…O—O △H=+134kJ/mol
第二步:O—N…O…C—O→NO(g)+CO2(g) △H=-368kJ/mol
总反应式:NO2(g)+CO(g)→NO(g)+CO2(g) △H=___kJ/mol
(2)对于任意一个化学反应,通过实验可以确定其反应速率与反应物浓度的定量关系:γ=kcm(NO2)·cn(CO),该方程称为速率方程,其中k称为速率常数。分析表中数据,写出该反应的速率方程表达式:___。

II.活性炭也可处理大气污染物NO,其原理:2NO(g)+C(s)![]() CO2(g)+N2(g) △H>0。在T℃时,在容积一定的刚性容器中加入NO气体和活性炭粉,使之发生反应测得各物质的物质的量如下:
CO2(g)+N2(g) △H>0。在T℃时,在容积一定的刚性容器中加入NO气体和活性炭粉,使之发生反应测得各物质的物质的量如下:
![]()
(3)计算T℃时,该反应的平衡常数K=___。
(4)为了提高NO的转化率和反应速率,可采取的措施有___(填字母)。
A.增加NO的用量 B.增加活性炭的用量
C.升高温度 D.增大体系压强
Ⅲ.用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示。

(5)电极I电极反应式为___。
(6)电解时H+的移动方向___(填“从左向右”、“从右向左”或“不移动”)
(7)标况下,每处理1molNO的同时,可产生O2的体积___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:L(s)+aG(g)![]() bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
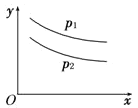
A. 上述反应是放热反应B. 上述反应是吸热反应
C. a+1>bD. a+1<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
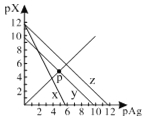
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是
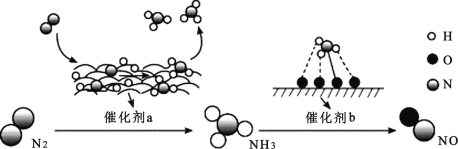
A.催化剂 a 表面发生了共价键的断裂和形成,但分子总数不变
B.在催化剂b 表面形成新的共价键时,存在微粒间的电子转移
C.N2 与H2 反应生成 NH3 的原子利用率不足 100%
D.催化剂 a、b 能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平。一段时间后能观察到铁钉生锈。下列说法不正确的是( )
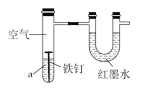
A. 铁钉表面发生的反应为Fe-3e-=Fe3+
B. 若液体a为稀醋酸,则U形管液面右高左低
C. 若液体a为食盐水,则U形管液面左高右低
D. 若液体a为食用油,则铁钉生锈速率较慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是
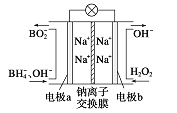
A. 该电池的负极反应为BH4-+8OH--8e-=BO2-+6H2O
B. 电池放电时Na+从b极区移向a极区
C. 每消耗3 mol H2O2,转移的电子为3 mol
D. 电极a采用MnO2作电极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL18mol·L-1的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量是( )
A.等于0.9molB.大于0.45mol,小于0.9mol
C.等于0.45molD.小于0.45mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com