
【题目】不能说明元素X的电负性比元素Y的大的是 ( )
A. 与H2化合时X单质比Y单质容易
B. X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
C. X原子的最外层电子数比Y原子的最外层电子数多
D. X单质可以把Y从其氢化物中置换出来
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】能用H++OH﹣=H2O表示的是( )
A.NaOH溶液和CO2的反应
B.Cu(OH)2和稀H2SO4的反应
C.Ba(OH)2溶液和盐酸反应
D.CaCO3和稀H2SO4的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备化肥X和Mn3O4的工艺流程如下:
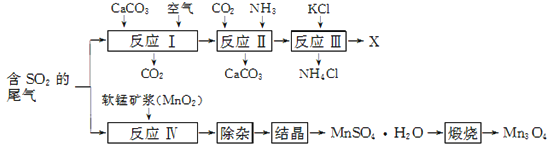
请回答下列问题:
(1) 几种盐的溶解度见下如图。化肥X的化学式为________;为获得固体X,加入KCl溶液后需对混合溶液进行蒸发浓缩,当析出大量晶体后,应________(填操作名称),再洗涤、干燥晶体。
(2) 检验X样品是否含有氯化物杂质的实验操作是________。
(3) 如图是隔绝空气条件煅烧MnSO4·H2O时剩余固体质量与温度的变化曲线,请写出A→B的化学方程式:____________________。
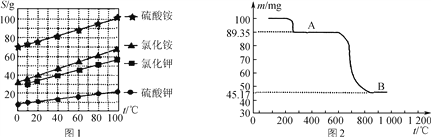
(4) 为了测定产品中Mn3O4的纯度,取2.500 g样品与浓盐酸共热(杂质不与盐酸反应),将产生的气体通入足量淀粉碘化钾溶液中,稀释至250 mL,从中取25.00 mL用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点时,消耗20.00 mL标准溶液(2Na2S2O3 +I2===2NaI+Na2S4O6)。
① 样品与浓盐酸发生反应的离子方程式为________。
② 该样品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.盐溶液都是中性的
B.盐溶液的酸碱性与盐的类型无关
C.碳酸钠溶液显碱性,是因为溶液中c(OH﹣)>c(H+)
D.NaHCO3溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7是一种橙红色固体,可用于火柴制造、电镀、有机合成等方面。用某酸性废液(主要含Cr3+、还含有少量Fe2+、Fe3+和Al3+等)制备的流程如下:

已知:H++CrO2-+H2O![]() Cr(OH)3
Cr(OH)3![]() Cr3++3OH-
Cr3++3OH-
回答下列问题:
(1)沉淀A的主要成分是_____________(填化学式,下同),流程中的X是__________。
(2)滤液Ⅰ中铬元素的存在形式主要是_____________(填离子符号)。
(3)操作是向滤液中加入稀硫酸调PH至一定范围。在酸性环境中CrO42-转化为Cr2O72-,溶液变为橙红色,该转化的离子方程式是__________;若PH高于此范围,造成的影响是__________。
(4)操作②是向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7,说明相同温度下,在水中的溶解度:Na2Cr2O7______________ K2Cr2O7(填“>”、“<”或“=”)。
(5)PbO2可直接将溶液中的Cr3+氧化成Cr2O72-,该反应的离子方程式是__________。
(6)K2Cr2O7可用来测定溶液中Fe2+的含量,还原产物为Cr3+。若1L FeSO4溶液与100mL 0.1mol/L K2Cr2O7溶液恰好完全反应,则c(FeSO4)=___________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu(NO3)2是重要的化工原料。回答下列工业生产和化学实验中的几个问题。
实验室欲制备0.3 mol Cu(NO3)2晶体,甲、乙两同学分别设计实验方案如下:
![]()
①绿色化学的角度分析,_________同学的方案更合理,此同学可节约2mol/L的稀硝酸_________mL;
②甲方案的离子方程式为___________;
③乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择__________方案(填字母序号)。

④B装置如何检查气密性:_________________。
(2)某校化学兴趣小组的同学对硝酸铜的受热分解进行探究。他们设计了如下左图装置加热Cu(NO3)2固体(加热及夹持装置未画出)。加热过程发现:装置①中的固体逐渐变为黑色;装置②中有气泡产生,但在上升的过程中消失;石蕊试液逐渐变为红色,液体几乎不被压至装置③中。请写出Cu(NO3)2受热分解的化学方程式:______________;


(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见上右图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是__________(填序号)
A.氢 B.碳 C.氧 D.硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有铝元素?___________。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为:________________。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为 _____________________________。
信息⑤:X与W同主族
(5)①X与浓硫酸加热时反应的化学方程式为______________________。
②工业上通过X与W的化合物制W的单质的化学方程式为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F和高分子化合物G,它们都是常用的塑料。
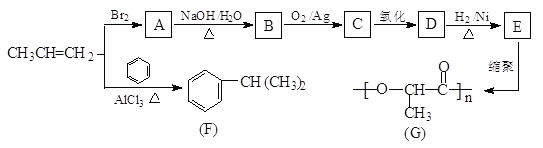
完成下列填空:
(1)F的分子式为_______________,化合物E中所含两个官能团的名称是____、______。
(2)写出反应类型:丙烯直接形成高分子______;A→B____________。
(3)B转化为C的化学方程式为____________。
(4)E的一种同分异构体M具有如下性质:①能发生银镜反应;②1molM与足量的金属钠反应可产生lmolH2,则M的结构简式为____________。
(5)写出由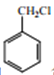 合成
合成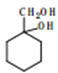 的合成路线________。
的合成路线________。
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【浙江省温州市2017届高三第二次选考模拟考试】有一种新型的固体氧化物型燃料电池,装置如图所示,在两极上分别通入甲烷和空气,电解质是掺杂了 Y2O3的ZrO3固体。在高温熔融状态下能传导O2-。下列说法正确的是

A. a处通入的甲烷
B. 工作时,在熔融电解质中,O2-离子移向d电极
C. c电极为正极,发生氧化反应
D. d电极的电极反应式:O2+4e-=2O2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com