
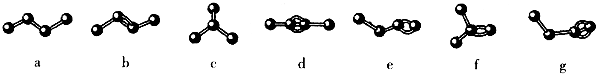
| A. | 只含4个碳原子的烃中,碳原子间的相互结合方式共有如图所示七种情况 | |
| B. | 以上七种物质均属于烷烃 | |
| C. | c和f分子的空间构型相同 | |
| D. | d与g互为同分异构体 |
科目:高中化学 来源: 题型:解答题

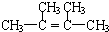 .
. 为不稳定结构.
为不稳定结构. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和NaHCO3均可与澄清石灰水反应 | |
| B. | NaHCO3比Na2CO3热稳定性强 | |
| C. | 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同 | |
| D. | Na2CO3俗名小苏打,NaHCO3俗名纯碱,其溶液均显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
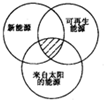
| A. | 煤炭、石油、潮汐能 | B. | 水能、生物质能、天然气 | ||
| C. | 太阳能、风能、生物质能 | D. | 地热能、海洋能、核能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 |  CuSO4溶液 | 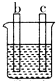 稀硫酸 | 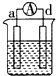 稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Fe电极作阳极,发生氧化反应 | |
| B. | Cl-向石墨极作定向运动 | |
| C. | 石墨电极反应:Fe3++3e-═Fe | |
| D. | 电解池发生总反应:2Cl${\;}_{\;}^{-}$+2Fe3+═Cl2+2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
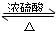 CH3COOC2H5+H2O,该反应的反应类型为取代或酯化反应.
CH3COOC2H5+H2O,该反应的反应类型为取代或酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com