
| A. | 可溶性铁盐或铝盐可用于水的净化 | |
| B. | 电解MgCl2溶液可制金属镁 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 |
科目:高中化学 来源: 题型:解答题
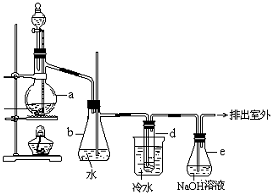 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,其中锥形瓶b是安全瓶,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,其中锥形瓶b是安全瓶,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 814.8 | 400.3 | 97.3 |
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 137.7 | 428.8 | 97.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 消去反应 | C. | 加成反应 | D. | 加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com